Wanneer iets brandt, geeft het energie vrij in de vorm van warmte en licht. De hoeveelheid energie die vrijkomt door een bepaalde vlam verschilt afhankelijk van de brandstof die wordt verbrand. U kunt de hoeveelheid energie die door een brandstof vrijkomt testen door de temperatuurverandering te meten die de vlam in een bak met water veroorzaakt. Een van de manieren om de energie te meten is door een calorimeter te maken, die de hoeveelheid warmte meet die is betrokken bij een chemische reactie of een thermisch proces.
Deel een van de drie:
Een eenvoudige calorimeter bouwen
-
 1 Meet water met een maatcilinder. Het is belangrijk om precies te weten hoeveel water u gebruikt. Hiermee kunt u berekenen hoeveel energie werd gebruikt om het water te verwarmen. Gebruik een maatcilinder om 100 milliliter (3,4 fl oz) water nauwkeurig te meten voor het experiment. Noteer dit bedrag in een notitieblok.[1]
1 Meet water met een maatcilinder. Het is belangrijk om precies te weten hoeveel water u gebruikt. Hiermee kunt u berekenen hoeveel energie werd gebruikt om het water te verwarmen. Gebruik een maatcilinder om 100 milliliter (3,4 fl oz) water nauwkeurig te meten voor het experiment. Noteer dit bedrag in een notitieblok.[1] -
 2 Giet het water in een blikje frisdrank. Een aluminium frisdrankblik kan de warmte efficiënter geleiden dan een glazen cilinder. Pas op dat u geen water morst. Het is belangrijk dat de hoeveelheid water die u hebt opgenomen correct is.[2]
2 Giet het water in een blikje frisdrank. Een aluminium frisdrankblik kan de warmte efficiënter geleiden dan een glazen cilinder. Pas op dat u geen water morst. Het is belangrijk dat de hoeveelheid water die u hebt opgenomen correct is.[2] -
 3 Zet het blik over uw brandstofbron. Aangezien de warmte stijgt, krijgt u de meeste warmteoverdracht als het blik recht boven de brandstofbron wordt geplaatst. Gebruik een standaard of bouw een eenvoudig apparaat van een soort om het blik 6-8 centimeter (2.4-3.1 in) boven de brandstofbron te houden. Gebruik metaal om het blik op zijn plaats te houden.[3]
3 Zet het blik over uw brandstofbron. Aangezien de warmte stijgt, krijgt u de meeste warmteoverdracht als het blik recht boven de brandstofbron wordt geplaatst. Gebruik een standaard of bouw een eenvoudig apparaat van een soort om het blik 6-8 centimeter (2.4-3.1 in) boven de brandstofbron te houden. Gebruik metaal om het blik op zijn plaats te houden.[3] - Materialen zoals hout of plastic kunnen smelten of vlam vatten. Gebruik daarom brandveilige materialen om de standaard te bouwen.
Tweede deel van de drie:
Temperatuurveranderingen meten
-
 1 Meet de begintemperatuur van het water. Zonder de begintemperatuur van het water, zult u niet weten hoeveel warmte werd opgenomen. Zet een thermometer in het water en lees wat. Noteer de waarde zodat u deze precies kunt onthouden.
1 Meet de begintemperatuur van het water. Zonder de begintemperatuur van het water, zult u niet weten hoeveel warmte werd opgenomen. Zet een thermometer in het water en lees wat. Noteer de waarde zodat u deze precies kunt onthouden. - Uw eerste meting kan bijvoorbeeld 20 ° C (68 ° F) zijn. Het is het beste om de meting in Celsius te doen, omdat dit je wiskunde later zal vereenvoudigen.
-
 2 Ontsteek de brandstof onder het water. Gebruik een lucifer of een aansteker om de brandstof te laten ontbranden. Gebruikelijke brandstoffen om te testen omvatten pindaolie, plantaardige olie, methanol of ethanol. Deze stap moet worden uitgevoerd door of met een toezichthoudende volwassene.[4]
2 Ontsteek de brandstof onder het water. Gebruik een lucifer of een aansteker om de brandstof te laten ontbranden. Gebruikelijke brandstoffen om te testen omvatten pindaolie, plantaardige olie, methanol of ethanol. Deze stap moet worden uitgevoerd door of met een toezichthoudende volwassene.[4] - Draag handschoenen en een veiligheidsbril om uw ogen en handen te beschermen.
- Voordat u de brandstof aansteekt, moet u een veiligheidsplan opstellen voor het geval er iets fout gaat of het vuur zich verspreidt. Houd een brandblusser in de buurt.
-
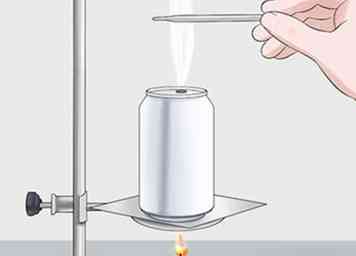 3 Neem een laatste temperatuurmeting van het water. Nadat alle brandstof is opgebrand of als u deze dooft, hebt u een tweede temperatuurmeting nodig. Gebruik dezelfde thermometer en steek deze in het water. Noteer de eindtemperatuur voor gebruik bij het berekenen van de energie die vrijkomt bij het verbranden van de brandstof.
3 Neem een laatste temperatuurmeting van het water. Nadat alle brandstof is opgebrand of als u deze dooft, hebt u een tweede temperatuurmeting nodig. Gebruik dezelfde thermometer en steek deze in het water. Noteer de eindtemperatuur voor gebruik bij het berekenen van de energie die vrijkomt bij het verbranden van de brandstof. - Uw uiteindelijke waarde moet hoger zijn dan uw oorspronkelijke waarde. Het kan bijvoorbeeld ongeveer 24 ° C (75 ° F) zijn, afhankelijk van uw brandstof.
Derde deel van de drie:
Berekening van energie vrijgegeven
-
 1 Zoek het verschil in temperatuur. Trek de begintemperatuur af van de eindtemperatuur. Dit zal u vertellen hoeveel de watertemperatuur is veranderd door de brandende brandstof eronder. Converteer dit getal naar Celsius als uw metingen niet in Celsius waren.
1 Zoek het verschil in temperatuur. Trek de begintemperatuur af van de eindtemperatuur. Dit zal u vertellen hoeveel de watertemperatuur is veranderd door de brandende brandstof eronder. Converteer dit getal naar Celsius als uw metingen niet in Celsius waren. - U kunt een getal van Fahrenheit naar Celsius converteren met behulp van de vergelijking waar C de temperatuur in Celsius is en F de temperatuur in Fahrenheit.
- Een voorbeeld is 24 ° C (75,2 ° F) - 20 ° C (68,0 ° F) = 4 ° C (39,2 ° F).
-
 2 Vermenigvuldig het temperatuurverschil met de specifieke waterwarmte. De specifieke warmte van water is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 graad Celsius te verhogen. Voor water is de soortelijke warmte 1 calorie per gram Celsius. Dat betekent dat het 1 calorie kost om 1 gram water te verwarmen met 1 graad Celsius.[5]
2 Vermenigvuldig het temperatuurverschil met de specifieke waterwarmte. De specifieke warmte van water is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 graad Celsius te verhogen. Voor water is de soortelijke warmte 1 calorie per gram Celsius. Dat betekent dat het 1 calorie kost om 1 gram water te verwarmen met 1 graad Celsius.[5] - De eenheid voor specifieke warmte wordt geschreven als 1 calorie / (gram x graden Celsius).
- Vermenigvuldig dit met het temperatuurverschil levert 4 graden Celsius x 1 calorie / (gram x graden Celsius) = 4 calorieën / gram.
-
 3 Factor in de massa van het water. Vermenigvuldig nu het product van het warmteverschil en soortelijke warmte met de hoeveelheid water die je hebt gebruikt. Merk op dat 1 ml water gelijk is aan 1 gram water. Zorg ervoor dat u het gram van het apparaat gebruikt.[6]
3 Factor in de massa van het water. Vermenigvuldig nu het product van het warmteverschil en soortelijke warmte met de hoeveelheid water die je hebt gebruikt. Merk op dat 1 ml water gelijk is aan 1 gram water. Zorg ervoor dat u het gram van het apparaat gebruikt.[6] - Dit levert je energetische release op: 4 calorieën / gram x 100 gram = 400 calorieën.
-
 4 Realiseer je dat je systeem wat energie verliest. Terwijl een deel van de vrijkomende warmte rechtstreeks het water in gaat, is je systeem niet perfect. Er gaat wat warmte verloren aan de omgevingslucht. Een kleine hoeveelheid warmte zal ook door de bus zelf worden opgenomen. Er is weinig dat kan worden gedaan om het warmteverlies te compenseren.[7]
4 Realiseer je dat je systeem wat energie verliest. Terwijl een deel van de vrijkomende warmte rechtstreeks het water in gaat, is je systeem niet perfect. Er gaat wat warmte verloren aan de omgevingslucht. Een kleine hoeveelheid warmte zal ook door de bus zelf worden opgenomen. Er is weinig dat kan worden gedaan om het warmteverlies te compenseren.[7] - Als u zeer nauwkeurige experimenten probeert uit te voeren, kunt u in een commerciële calorimeter investeren, maar zelfs dan zijn de resultaten mogelijk niet 100% efficiënt.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Meet water met een maatcilinder. Het is belangrijk om precies te weten hoeveel water u gebruikt. Hiermee kunt u berekenen hoeveel energie werd gebruikt om het water te verwarmen. Gebruik een maatcilinder om 100 milliliter (3,4 fl oz) water nauwkeurig te meten voor het experiment. Noteer dit bedrag in een notitieblok.[1]
1 Meet water met een maatcilinder. Het is belangrijk om precies te weten hoeveel water u gebruikt. Hiermee kunt u berekenen hoeveel energie werd gebruikt om het water te verwarmen. Gebruik een maatcilinder om 100 milliliter (3,4 fl oz) water nauwkeurig te meten voor het experiment. Noteer dit bedrag in een notitieblok.[1]  2 Giet het water in een blikje frisdrank. Een aluminium frisdrankblik kan de warmte efficiënter geleiden dan een glazen cilinder. Pas op dat u geen water morst. Het is belangrijk dat de hoeveelheid water die u hebt opgenomen correct is.[2]
2 Giet het water in een blikje frisdrank. Een aluminium frisdrankblik kan de warmte efficiënter geleiden dan een glazen cilinder. Pas op dat u geen water morst. Het is belangrijk dat de hoeveelheid water die u hebt opgenomen correct is.[2]  3 Zet het blik over uw brandstofbron. Aangezien de warmte stijgt, krijgt u de meeste warmteoverdracht als het blik recht boven de brandstofbron wordt geplaatst. Gebruik een standaard of bouw een eenvoudig apparaat van een soort om het blik 6-8 centimeter (2.4-3.1 in) boven de brandstofbron te houden. Gebruik metaal om het blik op zijn plaats te houden.[3]
3 Zet het blik over uw brandstofbron. Aangezien de warmte stijgt, krijgt u de meeste warmteoverdracht als het blik recht boven de brandstofbron wordt geplaatst. Gebruik een standaard of bouw een eenvoudig apparaat van een soort om het blik 6-8 centimeter (2.4-3.1 in) boven de brandstofbron te houden. Gebruik metaal om het blik op zijn plaats te houden.[3]  1 Meet de begintemperatuur van het water. Zonder de begintemperatuur van het water, zult u niet weten hoeveel warmte werd opgenomen. Zet een thermometer in het water en lees wat. Noteer de waarde zodat u deze precies kunt onthouden.
1 Meet de begintemperatuur van het water. Zonder de begintemperatuur van het water, zult u niet weten hoeveel warmte werd opgenomen. Zet een thermometer in het water en lees wat. Noteer de waarde zodat u deze precies kunt onthouden.  2 Ontsteek de brandstof onder het water. Gebruik een lucifer of een aansteker om de brandstof te laten ontbranden. Gebruikelijke brandstoffen om te testen omvatten pindaolie, plantaardige olie, methanol of ethanol. Deze stap moet worden uitgevoerd door of met een toezichthoudende volwassene.[4]
2 Ontsteek de brandstof onder het water. Gebruik een lucifer of een aansteker om de brandstof te laten ontbranden. Gebruikelijke brandstoffen om te testen omvatten pindaolie, plantaardige olie, methanol of ethanol. Deze stap moet worden uitgevoerd door of met een toezichthoudende volwassene.[4]  3 Neem een laatste temperatuurmeting van het water. Nadat alle brandstof is opgebrand of als u deze dooft, hebt u een tweede temperatuurmeting nodig. Gebruik dezelfde thermometer en steek deze in het water. Noteer de eindtemperatuur voor gebruik bij het berekenen van de energie die vrijkomt bij het verbranden van de brandstof.
3 Neem een laatste temperatuurmeting van het water. Nadat alle brandstof is opgebrand of als u deze dooft, hebt u een tweede temperatuurmeting nodig. Gebruik dezelfde thermometer en steek deze in het water. Noteer de eindtemperatuur voor gebruik bij het berekenen van de energie die vrijkomt bij het verbranden van de brandstof.  1 Zoek het verschil in temperatuur. Trek de begintemperatuur af van de eindtemperatuur. Dit zal u vertellen hoeveel de watertemperatuur is veranderd door de brandende brandstof eronder. Converteer dit getal naar Celsius als uw metingen niet in Celsius waren.
1 Zoek het verschil in temperatuur. Trek de begintemperatuur af van de eindtemperatuur. Dit zal u vertellen hoeveel de watertemperatuur is veranderd door de brandende brandstof eronder. Converteer dit getal naar Celsius als uw metingen niet in Celsius waren.  2 Vermenigvuldig het temperatuurverschil met de specifieke waterwarmte. De specifieke warmte van water is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 graad Celsius te verhogen. Voor water is de soortelijke warmte 1 calorie per gram Celsius. Dat betekent dat het 1 calorie kost om 1 gram water te verwarmen met 1 graad Celsius.[5]
2 Vermenigvuldig het temperatuurverschil met de specifieke waterwarmte. De specifieke warmte van water is de hoeveelheid warmte die nodig is om de temperatuur van 1 gram water met 1 graad Celsius te verhogen. Voor water is de soortelijke warmte 1 calorie per gram Celsius. Dat betekent dat het 1 calorie kost om 1 gram water te verwarmen met 1 graad Celsius.[5]  3 Factor in de massa van het water. Vermenigvuldig nu het product van het warmteverschil en soortelijke warmte met de hoeveelheid water die je hebt gebruikt. Merk op dat 1 ml water gelijk is aan 1 gram water. Zorg ervoor dat u het gram van het apparaat gebruikt.[6]
3 Factor in de massa van het water. Vermenigvuldig nu het product van het warmteverschil en soortelijke warmte met de hoeveelheid water die je hebt gebruikt. Merk op dat 1 ml water gelijk is aan 1 gram water. Zorg ervoor dat u het gram van het apparaat gebruikt.[6]  4 Realiseer je dat je systeem wat energie verliest. Terwijl een deel van de vrijkomende warmte rechtstreeks het water in gaat, is je systeem niet perfect. Er gaat wat warmte verloren aan de omgevingslucht. Een kleine hoeveelheid warmte zal ook door de bus zelf worden opgenomen. Er is weinig dat kan worden gedaan om het warmteverlies te compenseren.[7]
4 Realiseer je dat je systeem wat energie verliest. Terwijl een deel van de vrijkomende warmte rechtstreeks het water in gaat, is je systeem niet perfect. Er gaat wat warmte verloren aan de omgevingslucht. Een kleine hoeveelheid warmte zal ook door de bus zelf worden opgenomen. Er is weinig dat kan worden gedaan om het warmteverlies te compenseren.[7]