Organische chemie heeft een nare reputatie - het is niet ongewoon dat studenten horrorverhalen over de moeilijkheidsgraad van de klas horen voordat ze de kans krijgen om het zelf te nemen. Hoewel de klas een uitdagende kan zijn, is 'O Chem' niet de nachtmerrie die vaak wordt uitgebarsten. Er is minder informatie om te onthouden, maar meer processen om te begrijpen, dus een goed begrip van de grondbeginselen en een goed studieregime zijn de sleutel tot het behalen van een voldoende.
Deel een van de drie:
Basic O Chem Knowledge
-
 1 Leer de definitie van "organische chemie."Over het algemeen is organische chemie de studie van op koolstof gebaseerde chemische verbindingen.[1] Koolstof is het zesde element in het periodiek systeem en een van de meest vitale bouwstenen voor het leven op aarde. Levende dingen bestaan uit moleculen die voornamelijk uit koolstof bestaan. Dit betekent dat O chem de chemie bevat die elke dag in je lichaam doorgaat. Het bevat ook de chemie die optreedt in dieren, planten en natuurlijke ecosystemen.
1 Leer de definitie van "organische chemie."Over het algemeen is organische chemie de studie van op koolstof gebaseerde chemische verbindingen.[1] Koolstof is het zesde element in het periodiek systeem en een van de meest vitale bouwstenen voor het leven op aarde. Levende dingen bestaan uit moleculen die voornamelijk uit koolstof bestaan. Dit betekent dat O chem de chemie bevat die elke dag in je lichaam doorgaat. Het bevat ook de chemie die optreedt in dieren, planten en natuurlijke ecosystemen. - Organische chemie is echter niet beperkt tot levende wezens. De chemische reacties die betrokken zijn bij het verbranden van fossiele brandstoffen vallen bijvoorbeeld onder de paraplu van O chem omdat deze reacties op koolstof gebaseerde verbindingen in de brandstoffen omvatten.
-
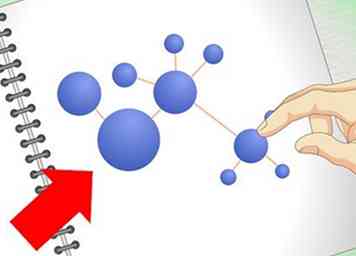 2 Leer de gemeenschappelijke manieren om moleculen te vertegenwoordigen. O chem is een meer "visueel" studiegebied dan de algemene chemie. Je zult vaker op tekeningen van moleculen en verbindingen vertrouwen dan in voorgaande scheikundelessen. Weten hoe je dit soort visuele representaties interpreteert, is een van de meest elementaire, belangrijke O-chemievaardigheden.
2 Leer de gemeenschappelijke manieren om moleculen te vertegenwoordigen. O chem is een meer "visueel" studiegebied dan de algemene chemie. Je zult vaker op tekeningen van moleculen en verbindingen vertrouwen dan in voorgaande scheikundelessen. Weten hoe je dit soort visuele representaties interpreteert, is een van de meest elementaire, belangrijke O-chemievaardigheden. - U moet bekend zijn met Lewis-structuren voordat u begint. Deze worden meestal als onderdeel van een algemene chemieopleiding onderwezen. In een Lewis-structuur worden atomen in een molecuul weergegeven door hun chemische symbool (hun letters op het periodiek systeem). Lijnen vertegenwoordigen de onderlinge bindingen en stippen vertegenwoordigen hun valentie-elektronen. Zie ons Lewis-structuurartikel voor een opfriscursus.
- Een manier om moleculen te tekenen die waarschijnlijk nieuw voor u zullen zijn, is de skeletale formule methode. In een skeletformule (ook wel "verbindingslijnstructuur" genoemd) worden koolstofatomen niet weergegeven. In plaats daarvan is er slechts een regel om de band te vertegenwoordigen. Omdat er zo veel koolstofatomen in O chem zitten, maakt dit het veel sneller om moleculen te trekken. Niet-koolstofatomen worden nog steeds weergegeven door hun chemische symbolen. Een goede gids voor skeletformaties is hier beschikbaar.[2]
-
 3 Leer hoe u obligaties kunt vertegenwoordigen. covalente obligaties zijn verreweg het meest voorkomende type obligaties waarmee je te maken hebt in O chem (hoewel kennis van ionische obligaties, enz. nog steeds waardevol is). In een covalente binding delen twee atomen ongepaarde elektronen om een binding te vormen. Als extra niet-gepaarde elektronen beschikbaar zijn, zijn dubbele of drievoudig gebonden atomen mogelijk.
3 Leer hoe u obligaties kunt vertegenwoordigen. covalente obligaties zijn verreweg het meest voorkomende type obligaties waarmee je te maken hebt in O chem (hoewel kennis van ionische obligaties, enz. nog steeds waardevol is). In een covalente binding delen twee atomen ongepaarde elektronen om een binding te vormen. Als extra niet-gepaarde elektronen beschikbaar zijn, zijn dubbele of drievoudig gebonden atomen mogelijk. - In zowel Lewis-structuren als skeletformules worden enkele bindingen weergegeven door één lijn, dubbele lijnen door een dubbele lijn en drievoudige bindingen door een drievoudige lijn.
- In skeletformules worden de bindingen tussen koolstof (C) en waterstof (H) -atomen meestal niet getekend omdat ze zo gewoon zijn.
- Behalve in speciale omstandigheden, mogen atomen meestal alleen acht valentie (buitenste schil) elektronen hebben. Dit betekent dat een atoom zich meestal aan maximaal vier andere atomen kan binden.
-
 4 Leer de basisprincipes van de 3-D moleculaire structuur. Organische chemie vereist dat studenten nadenken over chemische moleculen zoals ze dat doen werkelijk bestaan in het echte leven - niet alleen de manier waarop ze worden getekend. Moleculen nemen de vorm aan van driedimensionale structuren. De aard van de bindingen in het molecuul is het belangrijkste voor het bepalen van de 3D-vorm van een molecuul, hoewel andere factoren soms ook een rol kunnen spelen. Hieronder staan een paar dingen om te onthouden als het gaat om de vormen van koolstof-gebaseerde moleculen:
4 Leer de basisprincipes van de 3-D moleculaire structuur. Organische chemie vereist dat studenten nadenken over chemische moleculen zoals ze dat doen werkelijk bestaan in het echte leven - niet alleen de manier waarop ze worden getekend. Moleculen nemen de vorm aan van driedimensionale structuren. De aard van de bindingen in het molecuul is het belangrijkste voor het bepalen van de 3D-vorm van een molecuul, hoewel andere factoren soms ook een rol kunnen spelen. Hieronder staan een paar dingen om te onthouden als het gaat om de vormen van koolstof-gebaseerde moleculen: - Een koolstof gebonden aan vier andere atomen met enkele bindingen heeft de vorm van a viervlak (vierpuntige piramide). Een goed voorbeeld hiervan is het molecuul methaan (CH4)
- Een koolstof gebonden aan een ander atoom met een dubbele binding en twee atomen met enkele bindingen heeft een trigonale vlakke (platte driehoek) vorm. Het ion CO3-2 is hier een goed voorbeeld.
- Een koolstof gebonden aan twee atomen met dubbele bindingen of gebonden aan één album met een drievoudige binding heeft een lineair (stijve lijn) vorm. Het molecuul koolstofdioxide (CO2) is een voorbeeld.
-
 5 Leer om orbitale hybridisatie te ontcijferen. Dit onderwerp heeft een intimiderende naam, maar dat is het niet dat moeilijk te begrijpen. In wezen, hybride orbitalen zijn gewoon manieren waarop chemici de valentie-elektronen van een atoom vertegenwoordigen op basis van hoe dat atoom zich gedraagt (in plaats daarvan hoe het wordt getekend). Als een atoom een bepaald aantal ongepaarde elektronen beschikbaar heeft voor binding, maar de neiging heeft om een ander aantal banden te vormen, wordt er gezegd dat het "hybride orbitalen" heeft om het verschil te maken.
5 Leer om orbitale hybridisatie te ontcijferen. Dit onderwerp heeft een intimiderende naam, maar dat is het niet dat moeilijk te begrijpen. In wezen, hybride orbitalen zijn gewoon manieren waarop chemici de valentie-elektronen van een atoom vertegenwoordigen op basis van hoe dat atoom zich gedraagt (in plaats daarvan hoe het wordt getekend). Als een atoom een bepaald aantal ongepaarde elektronen beschikbaar heeft voor binding, maar de neiging heeft om een ander aantal banden te vormen, wordt er gezegd dat het "hybride orbitalen" heeft om het verschil te maken. - Carbon is hier een perfect voorbeeld van. Koolstofatomen hebben vier valentie-elektronen: twee in de 2s-orbitaal en twee ongepaarde elektronen in de 2p-orbitaal. Omdat er twee ongepaarde elektronen zijn, kan worden verwacht dat koolstof twee bindingen zal vormen. Experimenten tonen echter aan dat de gepaarde elektronen in de 2S-orbitaalverbindingen binden, ook al zijn ze niet ongepaired. We zeggen dus dat het koolstofatoom vier ongepaarde elektronen heeft in een sp-hybride orbitaal.
-
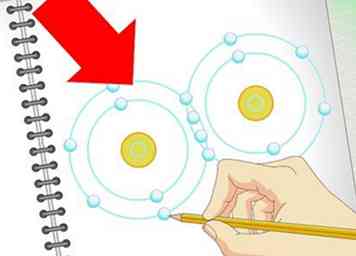
 6 Leer de basisprincipes van elektronegativiteit. Er zijn veel, vele factoren die kunnen bepalen hoe twee moleculen met elkaar reageren in O chem. Elektregativiteit is echter vaak een van de belangrijkste factoren. Elektronegativiteit is een manier om te meten hoe "strak" een gegeven atoom zijn elektronen vasthoudt. Atomen met een hoge elektronegativiteit hebben de neiging om hun elektronen stevig vast te houden (en omgekeerd voor atomen met lage elektronegativiteit). Zie ons elektronegativiteitsartikel voor gedetailleerde informatie.
6 Leer de basisprincipes van elektronegativiteit. Er zijn veel, vele factoren die kunnen bepalen hoe twee moleculen met elkaar reageren in O chem. Elektregativiteit is echter vaak een van de belangrijkste factoren. Elektronegativiteit is een manier om te meten hoe "strak" een gegeven atoom zijn elektronen vasthoudt. Atomen met een hoge elektronegativiteit hebben de neiging om hun elektronen stevig vast te houden (en omgekeerd voor atomen met lage elektronegativiteit). Zie ons elektronegativiteitsartikel voor gedetailleerde informatie. - Als je gaat naar boven en naar rechts in het periodiek systeem winnen atomen meer elektronegativiteit (waterstof en helium zijn niet inbegrepen). Fluor, het atoom rechtsboven, heeft de hoogste elektronegativiteit van allemaal.
- Omdat elektronegatieve atomen meer elektronen "willen", hebben ze de neiging te reageren door beschikbare elektronen op andere moleculen te "grijpen". Atomen zoals chloor en fluor verschijnen bijvoorbeeld vaak als negatieve ionen omdat ze elektronen hebben genomen van andere atomen.[3]
Tweede deel van de drie:
Studietips
-
 1 Wees niet geïntimideerd. Organische chemie introduceert veel nieuwe concepten en dwingt je op nieuwe manieren na te denken over chemieproblemen. Je zult een hele nieuwe chemie "vocabulaire" moeten leren. Relax - iedereen in jouw klas staat voor dezelfde uitdagingen. Bestudeer je aandacht en krijg de hulp die je nodig hebt en je zult waarschijnlijk in orde zijn.
1 Wees niet geïntimideerd. Organische chemie introduceert veel nieuwe concepten en dwingt je op nieuwe manieren na te denken over chemieproblemen. Je zult een hele nieuwe chemie "vocabulaire" moeten leren. Relax - iedereen in jouw klas staat voor dezelfde uitdagingen. Bestudeer je aandacht en krijg de hulp die je nodig hebt en je zult waarschijnlijk in orde zijn. - Laat geen griezelverhalen van mensen die O chem hebben genomen je bereiken. Studenten hebben de neiging om te verfraaien hoe moeilijk hun ervaringen waren. Als je je eerste test doodsbang tegemoet gaat dat je voor een onmogelijke uitdaging staat, wordt het alleen maar moeilijker.[4] In plaats daarvan kun je je zelfvertrouwen vergroten door veel tijd te besteden aan studeren en genoeg rust krijgen de avond ervoor.
-
 2 Concentreer je eerder op begrijpen dan op memoriseren. Je zult waarschijnlijk honderden verschillende reacties zien in je O chem-klas. Het is vrijwel onmogelijk om ze allemaal te onthouden, dus verspil je tijd niet aan het onthouden van de belangrijkste. In plaats daarvan, focus je op de Basisprincipes achter de meest voorkomende reacties. De meeste reacties volgen slechts een paar patronen, dus het goed begrijpen van deze patronen en weten hoe ze moeten worden toegepast, is een veel efficiëntere manier om problemen op te lossen.
2 Concentreer je eerder op begrijpen dan op memoriseren. Je zult waarschijnlijk honderden verschillende reacties zien in je O chem-klas. Het is vrijwel onmogelijk om ze allemaal te onthouden, dus verspil je tijd niet aan het onthouden van de belangrijkste. In plaats daarvan, focus je op de Basisprincipes achter de meest voorkomende reacties. De meeste reacties volgen slechts een paar patronen, dus het goed begrijpen van deze patronen en weten hoe ze moeten worden toegepast, is een veel efficiëntere manier om problemen op te lossen. - Als je echter goed bent in het memoriseren, kun je dit nog steeds in je voordeel gebruiken. Probeer basisreactiemechanismen op flashcards te schrijven en deze te gebruiken om de reacties te onthouden. Je zult nog steeds je kennis moeten kunnen aanpassen wanneer je reacties ziet waarvan je niet bekend bent, maar je kunt de basisprincipes gebruiken om je naar het juiste mechanisme te begeleiden.
-
 3 Ken je functionele groepen. Basic O chem gebruikt dezelfde reeks reactieve structuren in bijna al zijn moleculen. Deze structuren staan bekend als 'functionele groepen'. Weten hoe deze functionele groepen moeten worden geïdentificeerd en hoe ze de neiging hebben om te reageren, is cruciaal voor veel O chem-opdrachten. Aangezien functionele groepen meestal op dezelfde manier reageren op consistentie, kunt u met een kennis van hun eigenschappen een groot aantal verschillende problemen oplossen.
3 Ken je functionele groepen. Basic O chem gebruikt dezelfde reeks reactieve structuren in bijna al zijn moleculen. Deze structuren staan bekend als 'functionele groepen'. Weten hoe deze functionele groepen moeten worden geïdentificeerd en hoe ze de neiging hebben om te reageren, is cruciaal voor veel O chem-opdrachten. Aangezien functionele groepen meestal op dezelfde manier reageren op consistentie, kunt u met een kennis van hun eigenschappen een groot aantal verschillende problemen oplossen. - Er zijn te veel functionele groepen in de organische chemie om op te nemen in dit artikel. Het is echter niet moeilijk om online gidsen voor de functionele groepen te vinden. Een goede gids van Purdue University is hier bijvoorbeeld beschikbaar.
-
 4 Volg bij twijfel de stroom van elektronen. Op het meest basale niveau hebben de meeste organische chemie-reacties alleen betrekking op twee of meer moleculen die elektronen uitwisselen. Als u niet kunt achterhalen hoe u aan de slag kunt gaan met een reactiemechanisme, begin dan met het zoeken naar plaatsen waar het logisch is dat elektronen worden overgedragen. Met andere woorden, kijk naar atomen die lijken op vooral goede elektronenacceptoren en atomen die eruit zien als bijzonder goede elektronendonoren. Maak de overdracht en vraag vervolgens: "Wat moet ik nu doen om mijn nieuwe moleculen in een stabiele staat te krijgen?"
4 Volg bij twijfel de stroom van elektronen. Op het meest basale niveau hebben de meeste organische chemie-reacties alleen betrekking op twee of meer moleculen die elektronen uitwisselen. Als u niet kunt achterhalen hoe u aan de slag kunt gaan met een reactiemechanisme, begin dan met het zoeken naar plaatsen waar het logisch is dat elektronen worden overgedragen. Met andere woorden, kijk naar atomen die lijken op vooral goede elektronenacceptoren en atomen die eruit zien als bijzonder goede elektronendonoren. Maak de overdracht en vraag vervolgens: "Wat moet ik nu doen om mijn nieuwe moleculen in een stabiele staat te krijgen?" - Aangezien zuurstof (O) bijvoorbeeld meer elektronegatief is dan koolstof, heeft de O, die dubbel aan C gebonden is in een ketongroep, de neiging de elektronen in de binding dichter bij zichzelf te houden. Dit geeft C een gedeeltelijk positieve lading en maakt het een goede kandidaat om elektronen te ontvangen. Als u een goede elektronendonor bij de reactie betrokken hebt, is het logisch dat het de C kan aanvallen, een nieuwe band kan vormen en uw reactie kan starten.
-
 5 Gebruik studiegroepen voor huiswerk en tests. Heb nooit het gevoel dat je de organische chemie alleen moet aanpakken. Samenkomen om je werk met je medestudenten te doen is een fantastisch idee. Niet alleen kunnen anderen je helpen met concepten waar je mee worstelt, je kunt ook een beter begrip krijgen van materiaal dat je al kent door het aan iemand anders uit te leggen.
5 Gebruik studiegroepen voor huiswerk en tests. Heb nooit het gevoel dat je de organische chemie alleen moet aanpakken. Samenkomen om je werk met je medestudenten te doen is een fantastisch idee. Niet alleen kunnen anderen je helpen met concepten waar je mee worstelt, je kunt ook een beter begrip krijgen van materiaal dat je al kent door het aan iemand anders uit te leggen.
Derde deel van de drie:
Hulp krijgen
-
 1 Leer je professor kennen. De persoon met de beste kennis van O chem in uw klas is de persoon die de klas lesgeeft. Profiteer van deze waardevolle bron. Ga naar het kantoor van je leraar om de gebieden te bespreken waar je problemen mee hebt. Probeer een paar duidelijke, beknopte vragen te stellen of een of twee problemen waar u problemen mee hebt. Wees klaar om het denkproces uit te leggen waardoor je het verkeerde antwoord kreeg.
1 Leer je professor kennen. De persoon met de beste kennis van O chem in uw klas is de persoon die de klas lesgeeft. Profiteer van deze waardevolle bron. Ga naar het kantoor van je leraar om de gebieden te bespreken waar je problemen mee hebt. Probeer een paar duidelijke, beknopte vragen te stellen of een of twee problemen waar u problemen mee hebt. Wees klaar om het denkproces uit te leggen waardoor je het verkeerde antwoord kreeg. - Loop niet naar het kantoor van je professor zonder een duidelijk idee te hebben van wat je wilt. Gewoon zeggen "Ik krijg niet het huiswerk" krijgt u geen nuttige hulp.
- Dit is niet alleen een geweldige manier om je vragen te beantwoorden, het kan je ook helpen om je professor te leren kennen. Houd er rekening mee dat als je op een grad school gericht bent, je in de toekomst een paar academische referenties nodig zult hebben. Hoogleraren schrijven veel positiever over mensen die de tijd namen om met ze te praten.
-
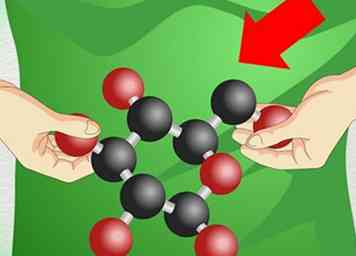 2 Gebruik hulpmiddelen om problemen te visualiseren. In O chem kunnen de vormen van moleculen bepalen hoe ze reageren. Omdat het moeilijk kan zijn om complexe 3D-moleculen op een vlak stuk papier weer te geven, is het gebruik van fysieke bouwstenen een geweldige manier om je hoofd in moeilijke structuren te wikkelen.
2 Gebruik hulpmiddelen om problemen te visualiseren. In O chem kunnen de vormen van moleculen bepalen hoe ze reageren. Omdat het moeilijk kan zijn om complexe 3D-moleculen op een vlak stuk papier weer te geven, is het gebruik van fysieke bouwstenen een geweldige manier om je hoofd in moeilijke structuren te wikkelen. - Met moleculaire modelsets bouw je moleculen uit plastic stukjes. Deze kunnen enigszins duur zijn als je ze koopt bij de boekhandel van je school of bij een leverancier van chemicaliën, maar sommige professoren zullen ze uitlenen aan studenten die er gratis om vragen.
- Als je een "echte" modelset niet kunt bemachtigen, probeer dan schuimballen, markers en houten deuvels van je plaatselijke ambachtelijke winkel te gebruiken voor een doe-het-zelf alternatief.
- Verschillende computerprogramma's (zoals hier beschikbaar) kunnen u ook helpen bij het modelleren van moleculen in drie dimensies.[5]
-
 3 Doe mee aan de discussie over helpforums. Een van de zilveren voeringen van de hoge moeilijkheidsgraad van O-chemie is die er zijn veel van studenten die online hulp zoeken (maar ook aanbieden). Verschillende online scheikundefora hebben grote gebruikersgemeenschappen die bereid zijn om moeilijke organische onderwerpen te bespreken. Probeer een probleem op te lossen waar je problemen mee hebt op een van deze forums en werk vervolgens samen met de mensen die reageren om de hulp te krijgen die je nodig hebt.
3 Doe mee aan de discussie over helpforums. Een van de zilveren voeringen van de hoge moeilijkheidsgraad van O-chemie is die er zijn veel van studenten die online hulp zoeken (maar ook aanbieden). Verschillende online scheikundefora hebben grote gebruikersgemeenschappen die bereid zijn om moeilijke organische onderwerpen te bespreken. Probeer een probleem op te lossen waar je problemen mee hebt op een van deze forums en werk vervolgens samen met de mensen die reageren om de hulp te krijgen die je nodig hebt. - Hoewel er veel forums zijn voor dit soort problemen, is chemicalforums.com een goede plek om te beginnen.[6]
-
 4 Gebruik online O chem resources. Een grote verscheidenheid aan sites kan helpen bij moeilijke O chem-onderwerpen. Slechts een paar goede bronnen staan hieronder vermeld:
4 Gebruik online O chem resources. Een grote verscheidenheid aan sites kan helpen bij moeilijke O chem-onderwerpen. Slechts een paar goede bronnen staan hieronder vermeld: - Khan Academy: organiseert tal van video-lezingen met verschillende basisonderwerpen.[7]
- Chem Helper: heeft links naar oefentests, hulpforums, reactiemechanismen en meer. Omvat ook laboratoriumhulp.[8]
- Aiken van de universiteit van South Carolina: bevat een eigen directory met nuttige websites over verschillende O chem-onderwerpen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Leer de definitie van "organische chemie."Over het algemeen is organische chemie de studie van op koolstof gebaseerde chemische verbindingen.[1] Koolstof is het zesde element in het periodiek systeem en een van de meest vitale bouwstenen voor het leven op aarde. Levende dingen bestaan uit moleculen die voornamelijk uit koolstof bestaan. Dit betekent dat O chem de chemie bevat die elke dag in je lichaam doorgaat. Het bevat ook de chemie die optreedt in dieren, planten en natuurlijke ecosystemen.
1 Leer de definitie van "organische chemie."Over het algemeen is organische chemie de studie van op koolstof gebaseerde chemische verbindingen.[1] Koolstof is het zesde element in het periodiek systeem en een van de meest vitale bouwstenen voor het leven op aarde. Levende dingen bestaan uit moleculen die voornamelijk uit koolstof bestaan. Dit betekent dat O chem de chemie bevat die elke dag in je lichaam doorgaat. Het bevat ook de chemie die optreedt in dieren, planten en natuurlijke ecosystemen.  2 Leer de gemeenschappelijke manieren om moleculen te vertegenwoordigen. O chem is een meer "visueel" studiegebied dan de algemene chemie. Je zult vaker op tekeningen van moleculen en verbindingen vertrouwen dan in voorgaande scheikundelessen. Weten hoe je dit soort visuele representaties interpreteert, is een van de meest elementaire, belangrijke O-chemievaardigheden.
2 Leer de gemeenschappelijke manieren om moleculen te vertegenwoordigen. O chem is een meer "visueel" studiegebied dan de algemene chemie. Je zult vaker op tekeningen van moleculen en verbindingen vertrouwen dan in voorgaande scheikundelessen. Weten hoe je dit soort visuele representaties interpreteert, is een van de meest elementaire, belangrijke O-chemievaardigheden.  3 Leer hoe u obligaties kunt vertegenwoordigen. covalente obligaties zijn verreweg het meest voorkomende type obligaties waarmee je te maken hebt in O chem (hoewel kennis van ionische obligaties, enz. nog steeds waardevol is). In een covalente binding delen twee atomen ongepaarde elektronen om een binding te vormen. Als extra niet-gepaarde elektronen beschikbaar zijn, zijn dubbele of drievoudig gebonden atomen mogelijk.
3 Leer hoe u obligaties kunt vertegenwoordigen. covalente obligaties zijn verreweg het meest voorkomende type obligaties waarmee je te maken hebt in O chem (hoewel kennis van ionische obligaties, enz. nog steeds waardevol is). In een covalente binding delen twee atomen ongepaarde elektronen om een binding te vormen. Als extra niet-gepaarde elektronen beschikbaar zijn, zijn dubbele of drievoudig gebonden atomen mogelijk.  4 Leer de basisprincipes van de 3-D moleculaire structuur. Organische chemie vereist dat studenten nadenken over chemische moleculen zoals ze dat doen werkelijk bestaan in het echte leven - niet alleen de manier waarop ze worden getekend. Moleculen nemen de vorm aan van driedimensionale structuren. De aard van de bindingen in het molecuul is het belangrijkste voor het bepalen van de 3D-vorm van een molecuul, hoewel andere factoren soms ook een rol kunnen spelen. Hieronder staan een paar dingen om te onthouden als het gaat om de vormen van koolstof-gebaseerde moleculen:
4 Leer de basisprincipes van de 3-D moleculaire structuur. Organische chemie vereist dat studenten nadenken over chemische moleculen zoals ze dat doen werkelijk bestaan in het echte leven - niet alleen de manier waarop ze worden getekend. Moleculen nemen de vorm aan van driedimensionale structuren. De aard van de bindingen in het molecuul is het belangrijkste voor het bepalen van de 3D-vorm van een molecuul, hoewel andere factoren soms ook een rol kunnen spelen. Hieronder staan een paar dingen om te onthouden als het gaat om de vormen van koolstof-gebaseerde moleculen:  5 Leer om orbitale hybridisatie te ontcijferen. Dit onderwerp heeft een intimiderende naam, maar dat is het niet dat moeilijk te begrijpen. In wezen, hybride orbitalen zijn gewoon manieren waarop chemici de valentie-elektronen van een atoom vertegenwoordigen op basis van hoe dat atoom zich gedraagt (in plaats daarvan hoe het wordt getekend). Als een atoom een bepaald aantal ongepaarde elektronen beschikbaar heeft voor binding, maar de neiging heeft om een ander aantal banden te vormen, wordt er gezegd dat het "hybride orbitalen" heeft om het verschil te maken.
5 Leer om orbitale hybridisatie te ontcijferen. Dit onderwerp heeft een intimiderende naam, maar dat is het niet dat moeilijk te begrijpen. In wezen, hybride orbitalen zijn gewoon manieren waarop chemici de valentie-elektronen van een atoom vertegenwoordigen op basis van hoe dat atoom zich gedraagt (in plaats daarvan hoe het wordt getekend). Als een atoom een bepaald aantal ongepaarde elektronen beschikbaar heeft voor binding, maar de neiging heeft om een ander aantal banden te vormen, wordt er gezegd dat het "hybride orbitalen" heeft om het verschil te maken.  6 Leer de basisprincipes van elektronegativiteit. Er zijn veel, vele factoren die kunnen bepalen hoe twee moleculen met elkaar reageren in O chem. Elektregativiteit is echter vaak een van de belangrijkste factoren. Elektronegativiteit is een manier om te meten hoe "strak" een gegeven atoom zijn elektronen vasthoudt. Atomen met een hoge elektronegativiteit hebben de neiging om hun elektronen stevig vast te houden (en omgekeerd voor atomen met lage elektronegativiteit). Zie ons elektronegativiteitsartikel voor gedetailleerde informatie.
6 Leer de basisprincipes van elektronegativiteit. Er zijn veel, vele factoren die kunnen bepalen hoe twee moleculen met elkaar reageren in O chem. Elektregativiteit is echter vaak een van de belangrijkste factoren. Elektronegativiteit is een manier om te meten hoe "strak" een gegeven atoom zijn elektronen vasthoudt. Atomen met een hoge elektronegativiteit hebben de neiging om hun elektronen stevig vast te houden (en omgekeerd voor atomen met lage elektronegativiteit). Zie ons elektronegativiteitsartikel voor gedetailleerde informatie.  1 Wees niet geïntimideerd. Organische chemie introduceert veel nieuwe concepten en dwingt je op nieuwe manieren na te denken over chemieproblemen. Je zult een hele nieuwe chemie "vocabulaire" moeten leren. Relax - iedereen in jouw klas staat voor dezelfde uitdagingen. Bestudeer je aandacht en krijg de hulp die je nodig hebt en je zult waarschijnlijk in orde zijn.
1 Wees niet geïntimideerd. Organische chemie introduceert veel nieuwe concepten en dwingt je op nieuwe manieren na te denken over chemieproblemen. Je zult een hele nieuwe chemie "vocabulaire" moeten leren. Relax - iedereen in jouw klas staat voor dezelfde uitdagingen. Bestudeer je aandacht en krijg de hulp die je nodig hebt en je zult waarschijnlijk in orde zijn.  2 Concentreer je eerder op begrijpen dan op memoriseren. Je zult waarschijnlijk honderden verschillende reacties zien in je O chem-klas. Het is vrijwel onmogelijk om ze allemaal te onthouden, dus verspil je tijd niet aan het onthouden van de belangrijkste. In plaats daarvan, focus je op de Basisprincipes achter de meest voorkomende reacties. De meeste reacties volgen slechts een paar patronen, dus het goed begrijpen van deze patronen en weten hoe ze moeten worden toegepast, is een veel efficiëntere manier om problemen op te lossen.
2 Concentreer je eerder op begrijpen dan op memoriseren. Je zult waarschijnlijk honderden verschillende reacties zien in je O chem-klas. Het is vrijwel onmogelijk om ze allemaal te onthouden, dus verspil je tijd niet aan het onthouden van de belangrijkste. In plaats daarvan, focus je op de Basisprincipes achter de meest voorkomende reacties. De meeste reacties volgen slechts een paar patronen, dus het goed begrijpen van deze patronen en weten hoe ze moeten worden toegepast, is een veel efficiëntere manier om problemen op te lossen.  3 Ken je functionele groepen. Basic O chem gebruikt dezelfde reeks reactieve structuren in bijna al zijn moleculen. Deze structuren staan bekend als 'functionele groepen'. Weten hoe deze functionele groepen moeten worden geïdentificeerd en hoe ze de neiging hebben om te reageren, is cruciaal voor veel O chem-opdrachten. Aangezien functionele groepen meestal op dezelfde manier reageren op consistentie, kunt u met een kennis van hun eigenschappen een groot aantal verschillende problemen oplossen.
3 Ken je functionele groepen. Basic O chem gebruikt dezelfde reeks reactieve structuren in bijna al zijn moleculen. Deze structuren staan bekend als 'functionele groepen'. Weten hoe deze functionele groepen moeten worden geïdentificeerd en hoe ze de neiging hebben om te reageren, is cruciaal voor veel O chem-opdrachten. Aangezien functionele groepen meestal op dezelfde manier reageren op consistentie, kunt u met een kennis van hun eigenschappen een groot aantal verschillende problemen oplossen.  4 Volg bij twijfel de stroom van elektronen. Op het meest basale niveau hebben de meeste organische chemie-reacties alleen betrekking op twee of meer moleculen die elektronen uitwisselen. Als u niet kunt achterhalen hoe u aan de slag kunt gaan met een reactiemechanisme, begin dan met het zoeken naar plaatsen waar het logisch is dat elektronen worden overgedragen. Met andere woorden, kijk naar atomen die lijken op vooral goede elektronenacceptoren en atomen die eruit zien als bijzonder goede elektronendonoren. Maak de overdracht en vraag vervolgens: "Wat moet ik nu doen om mijn nieuwe moleculen in een stabiele staat te krijgen?"
4 Volg bij twijfel de stroom van elektronen. Op het meest basale niveau hebben de meeste organische chemie-reacties alleen betrekking op twee of meer moleculen die elektronen uitwisselen. Als u niet kunt achterhalen hoe u aan de slag kunt gaan met een reactiemechanisme, begin dan met het zoeken naar plaatsen waar het logisch is dat elektronen worden overgedragen. Met andere woorden, kijk naar atomen die lijken op vooral goede elektronenacceptoren en atomen die eruit zien als bijzonder goede elektronendonoren. Maak de overdracht en vraag vervolgens: "Wat moet ik nu doen om mijn nieuwe moleculen in een stabiele staat te krijgen?"  5 Gebruik studiegroepen voor huiswerk en tests. Heb nooit het gevoel dat je de organische chemie alleen moet aanpakken. Samenkomen om je werk met je medestudenten te doen is een fantastisch idee. Niet alleen kunnen anderen je helpen met concepten waar je mee worstelt, je kunt ook een beter begrip krijgen van materiaal dat je al kent door het aan iemand anders uit te leggen.
5 Gebruik studiegroepen voor huiswerk en tests. Heb nooit het gevoel dat je de organische chemie alleen moet aanpakken. Samenkomen om je werk met je medestudenten te doen is een fantastisch idee. Niet alleen kunnen anderen je helpen met concepten waar je mee worstelt, je kunt ook een beter begrip krijgen van materiaal dat je al kent door het aan iemand anders uit te leggen.  1 Leer je professor kennen. De persoon met de beste kennis van O chem in uw klas is de persoon die de klas lesgeeft. Profiteer van deze waardevolle bron. Ga naar het kantoor van je leraar om de gebieden te bespreken waar je problemen mee hebt. Probeer een paar duidelijke, beknopte vragen te stellen of een of twee problemen waar u problemen mee hebt. Wees klaar om het denkproces uit te leggen waardoor je het verkeerde antwoord kreeg.
1 Leer je professor kennen. De persoon met de beste kennis van O chem in uw klas is de persoon die de klas lesgeeft. Profiteer van deze waardevolle bron. Ga naar het kantoor van je leraar om de gebieden te bespreken waar je problemen mee hebt. Probeer een paar duidelijke, beknopte vragen te stellen of een of twee problemen waar u problemen mee hebt. Wees klaar om het denkproces uit te leggen waardoor je het verkeerde antwoord kreeg.  2 Gebruik hulpmiddelen om problemen te visualiseren. In O chem kunnen de vormen van moleculen bepalen hoe ze reageren. Omdat het moeilijk kan zijn om complexe 3D-moleculen op een vlak stuk papier weer te geven, is het gebruik van fysieke bouwstenen een geweldige manier om je hoofd in moeilijke structuren te wikkelen.
2 Gebruik hulpmiddelen om problemen te visualiseren. In O chem kunnen de vormen van moleculen bepalen hoe ze reageren. Omdat het moeilijk kan zijn om complexe 3D-moleculen op een vlak stuk papier weer te geven, is het gebruik van fysieke bouwstenen een geweldige manier om je hoofd in moeilijke structuren te wikkelen.  3 Doe mee aan de discussie over helpforums. Een van de zilveren voeringen van de hoge moeilijkheidsgraad van O-chemie is die er zijn veel van studenten die online hulp zoeken (maar ook aanbieden). Verschillende online scheikundefora hebben grote gebruikersgemeenschappen die bereid zijn om moeilijke organische onderwerpen te bespreken. Probeer een probleem op te lossen waar je problemen mee hebt op een van deze forums en werk vervolgens samen met de mensen die reageren om de hulp te krijgen die je nodig hebt.
3 Doe mee aan de discussie over helpforums. Een van de zilveren voeringen van de hoge moeilijkheidsgraad van O-chemie is die er zijn veel van studenten die online hulp zoeken (maar ook aanbieden). Verschillende online scheikundefora hebben grote gebruikersgemeenschappen die bereid zijn om moeilijke organische onderwerpen te bespreken. Probeer een probleem op te lossen waar je problemen mee hebt op een van deze forums en werk vervolgens samen met de mensen die reageren om de hulp te krijgen die je nodig hebt.  4 Gebruik online O chem resources. Een grote verscheidenheid aan sites kan helpen bij moeilijke O chem-onderwerpen. Slechts een paar goede bronnen staan hieronder vermeld:
4 Gebruik online O chem resources. Een grote verscheidenheid aan sites kan helpen bij moeilijke O chem-onderwerpen. Slechts een paar goede bronnen staan hieronder vermeld: