Organische chemie is de studie van koolstof en zijn chemische verbindingen. Het onderwerp kan in het begin enorm en moeilijk te begrijpen zijn. Gelukkig is het met doorzettingsvermogen begrijpelijk. Het begrijpen van organische chemie is cruciaal voor iedereen die geïnteresseerd is in natuurlijke of door de mens gemaakte chemicaliën, inclusief die in voedingsmiddelen, dranken en zelfs onze eigen lichamen.
Deel een van de drie:
Herkennen van gemeenschappelijke organische chemie-reacties
-
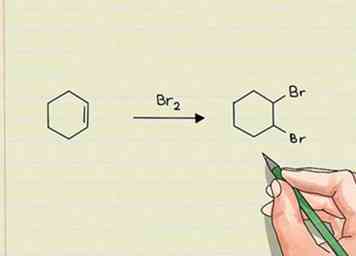 1 Zoek naar een groter aantal sigmabindingen om additiereacties te identificeren. Met andere woorden, kijk voor een groter aantal atomen dan in het oorspronkelijke molecuul. Dit wordt meestal toegestaan door een pi-binding of binding aan een set ongepaarde elektronen in het molecuul te verbreken. Toevoegingsreacties "wisselen" niet één atoom of groep voor een ander. Ze voegen gewoon iets nieuws toe.[1]
1 Zoek naar een groter aantal sigmabindingen om additiereacties te identificeren. Met andere woorden, kijk voor een groter aantal atomen dan in het oorspronkelijke molecuul. Dit wordt meestal toegestaan door een pi-binding of binding aan een set ongepaarde elektronen in het molecuul te verbreken. Toevoegingsreacties "wisselen" niet één atoom of groep voor een ander. Ze voegen gewoon iets nieuws toe.[1] - Toevoegingsreacties vinden meestal plaats wanneer dubbele of drievoudige bindingen worden aangevallen. Als er bijvoorbeeld een dubbele binding aanwezig is tussen twee koolstofatomen, en als waterstof door de binding wordt toegevoegd, zou dit ertoe leiden dat waterstof aan het molecuul wordt toegevoegd. Geen andere soort zou vertrekken.
-
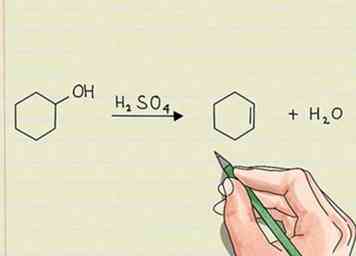 2 Zoek naar een verhoogd aantal pi-bindingen om eliminatiereacties aan te geven. Dit is het tegenovergestelde van een additiereactie. Er wordt iets weggenomen van het oorspronkelijke molecuul en er worden elektronen achtergelaten. Deze ongebonden elektronen verschijnen ofwel als een eenzaam paar of vormen een pi-binding in het molecuul.[2]
2 Zoek naar een verhoogd aantal pi-bindingen om eliminatiereacties aan te geven. Dit is het tegenovergestelde van een additiereactie. Er wordt iets weggenomen van het oorspronkelijke molecuul en er worden elektronen achtergelaten. Deze ongebonden elektronen verschijnen ofwel als een eenzaam paar of vormen een pi-binding in het molecuul.[2] - Als u waterstof uit een koolwaterstofketen verwijdert, zou het resultaat zijn dat de ongepaarde elektronen in een dubbele binding tussen twee koolstofatomen terechtkomen. Dit vereist niet dat er nog iets anders aan wordt toegevoegd, het verwijdert alleen de waterstof.
-
 3 Let op moleculaire "swapping" om de substitutiereacties te selecteren. Een substitutiereactie treedt op wanneer een groep (A) op het molecuul wordt verwijderd en vervangen door een nieuwe groep (B). Dit hoeft niet noodzakelijk het aantal pi- of sigma-bindingen in het molecuul te veranderen, zoals je zou zien bij additie- en eliminatiereacties. Veel voorkomende soorten substitutiereacties zijn:[3]
3 Let op moleculaire "swapping" om de substitutiereacties te selecteren. Een substitutiereactie treedt op wanneer een groep (A) op het molecuul wordt verwijderd en vervangen door een nieuwe groep (B). Dit hoeft niet noodzakelijk het aantal pi- of sigma-bindingen in het molecuul te veranderen, zoals je zou zien bij additie- en eliminatiereacties. Veel voorkomende soorten substitutiereacties zijn:[3] - Nucleofiele substitutie - Wanneer één nucleofiel een andere nucleofiel in de reactie vervangt.
- Elektrofiele substitutie - Wanneer een elektrofiel een ander elektrofiel in de reactie vervangt.
- SN1 - Een substitutiereactie waarbij slechts één molecuul in de overgangstoestand betrokken is. Met andere woorden, de vertrekkende groep vertrekt als eerste, en dan is de nieuwe groep vrij om het molecuul aan te vallen.[4]
- SN2 - Bij dit type reactie wordt de overgangstoestand gevormd uit twee moleculen. Dit gebeurt omdat de nieuwe groep het molecuul aanvalt op een beschikbare site en de vertrekkende groep gedwongen wordt weg te vallen.[5]
-
 4 Voer herschikkingsreacties uit wanneer het product dezelfde formule heeft als het oorspronkelijke molecuul. Herschikkingen vormen isomeren - moleculen die exact dezelfde atomen bevatten, maar in een andere configuratie. Isomeren hebben dezelfde chemische formule, maar verschillende eigenschappen die uniek zijn voor hun configuratie. Het aantal obligaties wordt meestal ook niet beïnvloed door herschikkingen.[6]
4 Voer herschikkingsreacties uit wanneer het product dezelfde formule heeft als het oorspronkelijke molecuul. Herschikkingen vormen isomeren - moleculen die exact dezelfde atomen bevatten, maar in een andere configuratie. Isomeren hebben dezelfde chemische formule, maar verschillende eigenschappen die uniek zijn voor hun configuratie. Het aantal obligaties wordt meestal ook niet beïnvloed door herschikkingen.[6] - Er is een subset van herrangschikkingsreacties bekend als tautomerisatie. Dit is wanneer twee isomeren snel heen en weer schakelen tussen elkaar.
-
 5 Overweeg andere belangrijke reacties die organische moleculen kunnen beïnvloeden. Oxidatie-reductie (of redox) reacties zijn heel gebruikelijk in de organische chemie, net als radicale reacties. Je moet enigszins bekend zijn met deze reacties van algemene anorganische chemie, maar het is een goed idee om ze te herzien.[7]
5 Overweeg andere belangrijke reacties die organische moleculen kunnen beïnvloeden. Oxidatie-reductie (of redox) reacties zijn heel gebruikelijk in de organische chemie, net als radicale reacties. Je moet enigszins bekend zijn met deze reacties van algemene anorganische chemie, maar het is een goed idee om ze te herzien.[7] - Als je doorgaat met het streven naar organische chemie, zul je meer gecompliceerde reacties tegenkomen die zich voordoen onder gespecialiseerde omstandigheden, maar ze zullen dezelfde basisprincipes volgen als alle organische reacties.
Tweede deel van de drie:
Inzicht in basale organische chemie trends
-
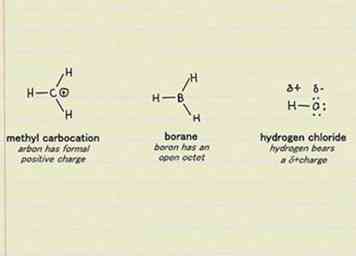 1 Identificeer elektrofielen in reactiemechanismen van organische chemie. Het woord elektrofiel verwijst naar "elektronminnende" soorten. Dit geldt voor atomen, moleculen en ionen. Als het een elektronenpaar kan accepteren, wordt het als een elektrofiel beschouwd. Onthoud alleen dat niet alle elektrofielen elektronen aantrekken met dezelfde intensiteit. Elektrofielen met hogere elektronegativiteiten zullen elektronen beter aantrekken dan elektronen met lagere elektronegativiteiten.[8]
1 Identificeer elektrofielen in reactiemechanismen van organische chemie. Het woord elektrofiel verwijst naar "elektronminnende" soorten. Dit geldt voor atomen, moleculen en ionen. Als het een elektronenpaar kan accepteren, wordt het als een elektrofiel beschouwd. Onthoud alleen dat niet alle elektrofielen elektronen aantrekken met dezelfde intensiteit. Elektrofielen met hogere elektronegativiteiten zullen elektronen beter aantrekken dan elektronen met lagere elektronegativiteiten.[8] - Kationen zijn goede voorbeelden van elektrofielen. Omdat ze een positieve netto lading hebben, worden ze aangetrokken door de negatieve lading van een elektron. Halogenen (chloor, fluor, enz.) Zijn ook sterke elektrofielen, omdat het verwerven van één elektron hun buitenste elektronenschil zal vullen, waardoor ze in het algemeen stabieler worden.
-
 2 Identificeer nucleofielen in reactiemechanismen van organische chemie. Nucleofielen zijn het perfecte compliment voor electrofielen. Een nucleofiel is een soort die in staat is om een paar elektronen te doneren. Soorten met lagere elektronegativiteiten zullen meer in staat zijn om elektronen te doneren, waardoor ze betere nucleofielen worden dan soorten met hogere elektronegativiteiten.[9]
2 Identificeer nucleofielen in reactiemechanismen van organische chemie. Nucleofielen zijn het perfecte compliment voor electrofielen. Een nucleofiel is een soort die in staat is om een paar elektronen te doneren. Soorten met lagere elektronegativiteiten zullen meer in staat zijn om elektronen te doneren, waardoor ze betere nucleofielen worden dan soorten met hogere elektronegativiteiten.[9] - Anionen hebben over het algemeen een negatieve lading en zijn vaak in staat om elektronen op te geven om stabieler te worden. Dit gebeurt meestal via ionische binding. Alkalische aardmetalen zoals natrium hebben ook de neiging om nucleofiel van aard te zijn, omdat het weggeven van een elektron hun buitenste elektronenschil zal stabiliseren.
-
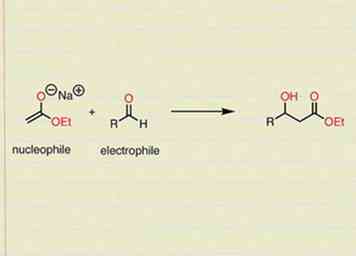 3 Vergeet niet dat nucleofielen electrofielen aanvallen in organische reacties. Dit is in essentie gewoon een manier om consequent naar mechanismen te kijken. Je zou je mechanisme moeten lezen alsof de nucleofiele verbinding opzoekt en reageert met de elektrofiele verbinding. Dit zal je helpen herinneren waar te beginnen en waar de elektronen naartoe gaan.
3 Vergeet niet dat nucleofielen electrofielen aanvallen in organische reacties. Dit is in essentie gewoon een manier om consequent naar mechanismen te kijken. Je zou je mechanisme moeten lezen alsof de nucleofiele verbinding opzoekt en reageert met de elektrofiele verbinding. Dit zal je helpen herinneren waar te beginnen en waar de elektronen naartoe gaan. - Een voorbeeld hiervan zou kunnen zijn dat je een molecuul hebt dat een dubbele binding bevat tussen twee van zijn koolstofatomen (pi-elektronen zijn gewoonlijk in staat om een nieuwe binding te vormen met een nieuwe soort), en een broom (halogeen) molecuul valt die dubbele binding aan.Het resultaat zou zijn dat de dubbele binding zou worden verbroken en het broom zou worden toegevoegd aan een van de twee koolstofatomen (welk koolstofatoom afhankelijk is van de omstandigheden en het type reactie).
-
 4 Maak kennis met andere grondslagen van de organische chemie. Hoewel organische chemie een enorm onderwerp is, zijn er belangrijke onderliggende principes die de meer complexe reacties bepalen. Als je bekend raakt met deze principes en hun toepassingen begrijpt, kun je zien hoe ze zich afspelen in de meest complexe set van organische reacties. Enkele van de belangrijkste fundamenten zijn:[10]
4 Maak kennis met andere grondslagen van de organische chemie. Hoewel organische chemie een enorm onderwerp is, zijn er belangrijke onderliggende principes die de meer complexe reacties bepalen. Als je bekend raakt met deze principes en hun toepassingen begrijpt, kun je zien hoe ze zich afspelen in de meest complexe set van organische reacties. Enkele van de belangrijkste fundamenten zijn:[10] - Stereochemie - Dit verwijst naar de manier waarop de vorm en grootte van een molecuul zijn reactiviteit beïnvloedt.[11]
- Resonantie - dit is wanneer een molecuul verschillende mogelijke elektronenconfiguraties heeft. Een elektronenpaar kan bijvoorbeeld worden gevonden in een dubbele binding of een functionele groep dichtbij. Deze flexibiliteit zorgt voor stabilisatie van het molecuul.[12]
- Aromatisering - Dit neemt de delocalisatie van elektronen in resonantie (het vermogen van elektronen om over het molecuul te delen) naar een ander niveau. In een aromatisch molecuul zijn er altijd (4n + 2) pi-elektronen en deze zijn gedelokaliseerd over een geconjugeerd pi-bindingenysteem of in een ring (zoals benzeen).[13]
- Functionele groepen - Deze groepen atomen zijn verantwoordelijk voor verschillende kenmerken van de moleculen waaraan ze zijn gekoppeld.
Derde deel van de drie:
Effectief bestuderen van organische chemie materialen
-
 1 Lees het boek voordat je naar de les komt. Hiermee kun je een voorbeeld van de informatie bekijken die in de colleges wordt behandeld. Je moet notities maken over wat je leest en ervoor zorgen dat ze overeenkomen met de aantekeningen die je tijdens het college neemt. Je moet ook vragen die je hebt tijdens het lezen noteren en ze vragen of de lezing ze niet voor je beantwoordt.
1 Lees het boek voordat je naar de les komt. Hiermee kun je een voorbeeld van de informatie bekijken die in de colleges wordt behandeld. Je moet notities maken over wat je leest en ervoor zorgen dat ze overeenkomen met de aantekeningen die je tijdens het college neemt. Je moet ook vragen die je hebt tijdens het lezen noteren en ze vragen of de lezing ze niet voor je beantwoordt. -
 2 Notitiekaarten maken voor verschillende organische reacties. Je zult er veel baat bij hebben als je de grote hoeveelheid informatie die in een organische chemie wordt behandeld, opneemt in notitiekaarten. Het systeem dat u voor uw notecards gebruikt, is afhankelijk van welke informatie u op dat moment wilt leren. Gooi je notitiekaarten niet weg. Laat ze elke week opnieuw bekijken en je zult veel beter af zijn voor het eindexamen.[14]
2 Notitiekaarten maken voor verschillende organische reacties. Je zult er veel baat bij hebben als je de grote hoeveelheid informatie die in een organische chemie wordt behandeld, opneemt in notitiekaarten. Het systeem dat u voor uw notecards gebruikt, is afhankelijk van welke informatie u op dat moment wilt leren. Gooi je notitiekaarten niet weg. Laat ze elke week opnieuw bekijken en je zult veel beter af zijn voor het eindexamen.[14] - U kunt bijvoorbeeld een set notakaarten maken voor een reeks additiereacties die u bestudeert. Op dezelfde manier kunt u een set notakaarten maken die de verschillende soorten reacties (toevoeging, eliminatie, vervanging, enz.) Omvatten. U kunt verschillende sets notakaarten maken, zoals de twee genoemde, die de informatie op verschillende manieren organiseren.
-
 3 Studeer organische chemie elke dag van het semester. Onderzoek toont aan dat het volstrekt niet effectief is om al je studies in één grote sessie te proppen. Je zult veel meer leren als je je studietijd spreidt. Vergeet niet om elke vijfenveertig minuten een studieonderbreking te nemen om je hersenen te laten rusten.[15]
3 Studeer organische chemie elke dag van het semester. Onderzoek toont aan dat het volstrekt niet effectief is om al je studies in één grote sessie te proppen. Je zult veel meer leren als je je studietijd spreidt. Vergeet niet om elke vijfenveertig minuten een studieonderbreking te nemen om je hersenen te laten rusten.[15] - Zorg ervoor dat je elke week teruggaat en materiaal uit het verleden bekijkt. Dit zal het materiaal vers houden en kan gemakkelijk worden gedaan door uw notecards te bekijken.
-
 4 Besteed tijd aan studeren in een groep. Zelfs als je liever alleen studeert, zul je verschillende manieren ontdekken om naar organische reacties te kijken. Andere studenten kunnen goed zijn in het bepalen welke reacties SN1 of SN2 zijn, terwijl je beter nucleofielen en elektrofielen kunt identificeren. Deze kennisuitwisseling zal iedereen ten goede komen.[16]
4 Besteed tijd aan studeren in een groep. Zelfs als je liever alleen studeert, zul je verschillende manieren ontdekken om naar organische reacties te kijken. Andere studenten kunnen goed zijn in het bepalen welke reacties SN1 of SN2 zijn, terwijl je beter nucleofielen en elektrofielen kunt identificeren. Deze kennisuitwisseling zal iedereen ten goede komen.[16] - Een andere manier om sociaal leren te benaderen, is door iemand anders te begeleiden of zelf een tutor te vinden.
-
 5 Neem oefenproblemen serieus. Als je oefenproblemen hebt, zullen je hersenen gedwongen worden om de informatie die je hebt geleerd terug te roepen. Dit is een essentiële vaardigheid voor het afleggen van de test. Het is ook een goed idee om tijd te nemen zodat u sneller kunt werken. Probeer praktijktesten te doen en werk aan het voltooien ervan in dezelfde hoeveelheid tijd die je in de les zult hebben.[17]
5 Neem oefenproblemen serieus. Als je oefenproblemen hebt, zullen je hersenen gedwongen worden om de informatie die je hebt geleerd terug te roepen. Dit is een essentiële vaardigheid voor het afleggen van de test. Het is ook een goed idee om tijd te nemen zodat u sneller kunt werken. Probeer praktijktesten te doen en werk aan het voltooien ervan in dezelfde hoeveelheid tijd die je in de les zult hebben.[17]
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Zoek naar een groter aantal sigmabindingen om additiereacties te identificeren. Met andere woorden, kijk voor een groter aantal atomen dan in het oorspronkelijke molecuul. Dit wordt meestal toegestaan door een pi-binding of binding aan een set ongepaarde elektronen in het molecuul te verbreken. Toevoegingsreacties "wisselen" niet één atoom of groep voor een ander. Ze voegen gewoon iets nieuws toe.[1]
1 Zoek naar een groter aantal sigmabindingen om additiereacties te identificeren. Met andere woorden, kijk voor een groter aantal atomen dan in het oorspronkelijke molecuul. Dit wordt meestal toegestaan door een pi-binding of binding aan een set ongepaarde elektronen in het molecuul te verbreken. Toevoegingsreacties "wisselen" niet één atoom of groep voor een ander. Ze voegen gewoon iets nieuws toe.[1]  2 Zoek naar een verhoogd aantal pi-bindingen om eliminatiereacties aan te geven. Dit is het tegenovergestelde van een additiereactie. Er wordt iets weggenomen van het oorspronkelijke molecuul en er worden elektronen achtergelaten. Deze ongebonden elektronen verschijnen ofwel als een eenzaam paar of vormen een pi-binding in het molecuul.[2]
2 Zoek naar een verhoogd aantal pi-bindingen om eliminatiereacties aan te geven. Dit is het tegenovergestelde van een additiereactie. Er wordt iets weggenomen van het oorspronkelijke molecuul en er worden elektronen achtergelaten. Deze ongebonden elektronen verschijnen ofwel als een eenzaam paar of vormen een pi-binding in het molecuul.[2]  3 Let op moleculaire "swapping" om de substitutiereacties te selecteren. Een substitutiereactie treedt op wanneer een groep (A) op het molecuul wordt verwijderd en vervangen door een nieuwe groep (B). Dit hoeft niet noodzakelijk het aantal pi- of sigma-bindingen in het molecuul te veranderen, zoals je zou zien bij additie- en eliminatiereacties. Veel voorkomende soorten substitutiereacties zijn:[3]
3 Let op moleculaire "swapping" om de substitutiereacties te selecteren. Een substitutiereactie treedt op wanneer een groep (A) op het molecuul wordt verwijderd en vervangen door een nieuwe groep (B). Dit hoeft niet noodzakelijk het aantal pi- of sigma-bindingen in het molecuul te veranderen, zoals je zou zien bij additie- en eliminatiereacties. Veel voorkomende soorten substitutiereacties zijn:[3]  4 Voer herschikkingsreacties uit wanneer het product dezelfde formule heeft als het oorspronkelijke molecuul. Herschikkingen vormen isomeren - moleculen die exact dezelfde atomen bevatten, maar in een andere configuratie. Isomeren hebben dezelfde chemische formule, maar verschillende eigenschappen die uniek zijn voor hun configuratie. Het aantal obligaties wordt meestal ook niet beïnvloed door herschikkingen.[6]
4 Voer herschikkingsreacties uit wanneer het product dezelfde formule heeft als het oorspronkelijke molecuul. Herschikkingen vormen isomeren - moleculen die exact dezelfde atomen bevatten, maar in een andere configuratie. Isomeren hebben dezelfde chemische formule, maar verschillende eigenschappen die uniek zijn voor hun configuratie. Het aantal obligaties wordt meestal ook niet beïnvloed door herschikkingen.[6]  5 Overweeg andere belangrijke reacties die organische moleculen kunnen beïnvloeden. Oxidatie-reductie (of redox) reacties zijn heel gebruikelijk in de organische chemie, net als radicale reacties. Je moet enigszins bekend zijn met deze reacties van algemene anorganische chemie, maar het is een goed idee om ze te herzien.[7]
5 Overweeg andere belangrijke reacties die organische moleculen kunnen beïnvloeden. Oxidatie-reductie (of redox) reacties zijn heel gebruikelijk in de organische chemie, net als radicale reacties. Je moet enigszins bekend zijn met deze reacties van algemene anorganische chemie, maar het is een goed idee om ze te herzien.[7]  1 Identificeer elektrofielen in reactiemechanismen van organische chemie. Het woord elektrofiel verwijst naar "elektronminnende" soorten. Dit geldt voor atomen, moleculen en ionen. Als het een elektronenpaar kan accepteren, wordt het als een elektrofiel beschouwd. Onthoud alleen dat niet alle elektrofielen elektronen aantrekken met dezelfde intensiteit. Elektrofielen met hogere elektronegativiteiten zullen elektronen beter aantrekken dan elektronen met lagere elektronegativiteiten.[8]
1 Identificeer elektrofielen in reactiemechanismen van organische chemie. Het woord elektrofiel verwijst naar "elektronminnende" soorten. Dit geldt voor atomen, moleculen en ionen. Als het een elektronenpaar kan accepteren, wordt het als een elektrofiel beschouwd. Onthoud alleen dat niet alle elektrofielen elektronen aantrekken met dezelfde intensiteit. Elektrofielen met hogere elektronegativiteiten zullen elektronen beter aantrekken dan elektronen met lagere elektronegativiteiten.[8]  2 Identificeer nucleofielen in reactiemechanismen van organische chemie. Nucleofielen zijn het perfecte compliment voor electrofielen. Een nucleofiel is een soort die in staat is om een paar elektronen te doneren. Soorten met lagere elektronegativiteiten zullen meer in staat zijn om elektronen te doneren, waardoor ze betere nucleofielen worden dan soorten met hogere elektronegativiteiten.[9]
2 Identificeer nucleofielen in reactiemechanismen van organische chemie. Nucleofielen zijn het perfecte compliment voor electrofielen. Een nucleofiel is een soort die in staat is om een paar elektronen te doneren. Soorten met lagere elektronegativiteiten zullen meer in staat zijn om elektronen te doneren, waardoor ze betere nucleofielen worden dan soorten met hogere elektronegativiteiten.[9]  3 Vergeet niet dat nucleofielen electrofielen aanvallen in organische reacties. Dit is in essentie gewoon een manier om consequent naar mechanismen te kijken. Je zou je mechanisme moeten lezen alsof de nucleofiele verbinding opzoekt en reageert met de elektrofiele verbinding. Dit zal je helpen herinneren waar te beginnen en waar de elektronen naartoe gaan.
3 Vergeet niet dat nucleofielen electrofielen aanvallen in organische reacties. Dit is in essentie gewoon een manier om consequent naar mechanismen te kijken. Je zou je mechanisme moeten lezen alsof de nucleofiele verbinding opzoekt en reageert met de elektrofiele verbinding. Dit zal je helpen herinneren waar te beginnen en waar de elektronen naartoe gaan.  4 Maak kennis met andere grondslagen van de organische chemie. Hoewel organische chemie een enorm onderwerp is, zijn er belangrijke onderliggende principes die de meer complexe reacties bepalen. Als je bekend raakt met deze principes en hun toepassingen begrijpt, kun je zien hoe ze zich afspelen in de meest complexe set van organische reacties. Enkele van de belangrijkste fundamenten zijn:[10]
4 Maak kennis met andere grondslagen van de organische chemie. Hoewel organische chemie een enorm onderwerp is, zijn er belangrijke onderliggende principes die de meer complexe reacties bepalen. Als je bekend raakt met deze principes en hun toepassingen begrijpt, kun je zien hoe ze zich afspelen in de meest complexe set van organische reacties. Enkele van de belangrijkste fundamenten zijn:[10]  1 Lees het boek voordat je naar de les komt. Hiermee kun je een voorbeeld van de informatie bekijken die in de colleges wordt behandeld. Je moet notities maken over wat je leest en ervoor zorgen dat ze overeenkomen met de aantekeningen die je tijdens het college neemt. Je moet ook vragen die je hebt tijdens het lezen noteren en ze vragen of de lezing ze niet voor je beantwoordt.
1 Lees het boek voordat je naar de les komt. Hiermee kun je een voorbeeld van de informatie bekijken die in de colleges wordt behandeld. Je moet notities maken over wat je leest en ervoor zorgen dat ze overeenkomen met de aantekeningen die je tijdens het college neemt. Je moet ook vragen die je hebt tijdens het lezen noteren en ze vragen of de lezing ze niet voor je beantwoordt.  2 Notitiekaarten maken voor verschillende organische reacties. Je zult er veel baat bij hebben als je de grote hoeveelheid informatie die in een organische chemie wordt behandeld, opneemt in notitiekaarten. Het systeem dat u voor uw notecards gebruikt, is afhankelijk van welke informatie u op dat moment wilt leren. Gooi je notitiekaarten niet weg. Laat ze elke week opnieuw bekijken en je zult veel beter af zijn voor het eindexamen.[14]
2 Notitiekaarten maken voor verschillende organische reacties. Je zult er veel baat bij hebben als je de grote hoeveelheid informatie die in een organische chemie wordt behandeld, opneemt in notitiekaarten. Het systeem dat u voor uw notecards gebruikt, is afhankelijk van welke informatie u op dat moment wilt leren. Gooi je notitiekaarten niet weg. Laat ze elke week opnieuw bekijken en je zult veel beter af zijn voor het eindexamen.[14]  3 Studeer organische chemie elke dag van het semester. Onderzoek toont aan dat het volstrekt niet effectief is om al je studies in één grote sessie te proppen. Je zult veel meer leren als je je studietijd spreidt. Vergeet niet om elke vijfenveertig minuten een studieonderbreking te nemen om je hersenen te laten rusten.[15]
3 Studeer organische chemie elke dag van het semester. Onderzoek toont aan dat het volstrekt niet effectief is om al je studies in één grote sessie te proppen. Je zult veel meer leren als je je studietijd spreidt. Vergeet niet om elke vijfenveertig minuten een studieonderbreking te nemen om je hersenen te laten rusten.[15]  4 Besteed tijd aan studeren in een groep. Zelfs als je liever alleen studeert, zul je verschillende manieren ontdekken om naar organische reacties te kijken. Andere studenten kunnen goed zijn in het bepalen welke reacties SN1 of SN2 zijn, terwijl je beter nucleofielen en elektrofielen kunt identificeren. Deze kennisuitwisseling zal iedereen ten goede komen.[16]
4 Besteed tijd aan studeren in een groep. Zelfs als je liever alleen studeert, zul je verschillende manieren ontdekken om naar organische reacties te kijken. Andere studenten kunnen goed zijn in het bepalen welke reacties SN1 of SN2 zijn, terwijl je beter nucleofielen en elektrofielen kunt identificeren. Deze kennisuitwisseling zal iedereen ten goede komen.[16]  5 Neem oefenproblemen serieus. Als je oefenproblemen hebt, zullen je hersenen gedwongen worden om de informatie die je hebt geleerd terug te roepen. Dit is een essentiële vaardigheid voor het afleggen van de test. Het is ook een goed idee om tijd te nemen zodat u sneller kunt werken. Probeer praktijktesten te doen en werk aan het voltooien ervan in dezelfde hoeveelheid tijd die je in de les zult hebben.[17]
5 Neem oefenproblemen serieus. Als je oefenproblemen hebt, zullen je hersenen gedwongen worden om de informatie die je hebt geleerd terug te roepen. Dit is een essentiële vaardigheid voor het afleggen van de test. Het is ook een goed idee om tijd te nemen zodat u sneller kunt werken. Probeer praktijktesten te doen en werk aan het voltooien ervan in dezelfde hoeveelheid tijd die je in de les zult hebben.[17]