Ionische verbindingen zijn een soort chemische verbinding die bestaat uit metaalkationen (positieve ionen) en niet-metaalanionen (negatieve ionen). Om een ionische verbinding te benoemen, moet je gewoon de namen van het kation en anion in de compound vinden en ervoor zorgen dat de uiteinden van de metalen namen naar behoefte worden herzien. Schrijf eerst de naam van het metaal op, gevolgd door de naam van het niet-metaal met zijn nieuwe einde. Als extra stap moet je de lading van het metaalion berekenen als je met een overgangsmetaal werkt.
Methode één van de drie:
Basis Ionische verbindingen benoemen
- 1 Raadpleeg het periodiek systeem der elementen. Bij het benoemen van ionische verbindingen is alle informatie die u nodig heeft aan het periodiek systeem. Ionische verbindingen worden gevormd van een metaal (kation) en een niet-metaal (anion). Je vindt metalen in de linker- en middensecties van het periodiek systeem (bijvoorbeeld Barium, Radium en Lood), terwijl je niet-metalen aan de rechterkant van de tafel kunt vinden.[1]
- Anionen behoren meestal tot de groepen 15, 16 of 17 in het periodiek systeem.[2] De meeste versies van het periodiek systeem hebben een kleurcode om aan te geven welke elementen van metaal en niet-metaal zijn.
- Als u geen gemakkelijke toegang hebt tot een exemplaar van de tabel, kunt u deze online openen op: https://www.ptable.com/.
-
 2 Noteer de formule van de ionische verbinding. Laten we zeggen dat de ionische verbinding waarmee u werkt is NaCl. Gebruik een pen of potlood om dit op een vel papier op te schrijven. Of, als u in een klaslokaal werkt, schrijft u "NaCl" op het whiteboard.
2 Noteer de formule van de ionische verbinding. Laten we zeggen dat de ionische verbinding waarmee u werkt is NaCl. Gebruik een pen of potlood om dit op een vel papier op te schrijven. Of, als u in een klaslokaal werkt, schrijft u "NaCl" op het whiteboard. - Dit is een voorbeeld van een basische ionische verbinding. Basische verbindingen bevatten geen overgangsmetalen en bevatten slechts 2 ionen.
-
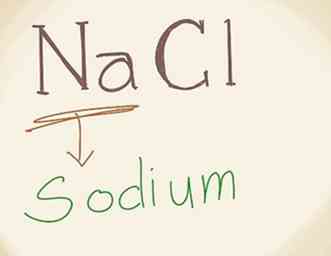 3 Schrijf de naam van het metaal. Het eerste deel van een ionische verbinding wordt het "kation" genoemd, wat een metaal is. Dit is het positief geladen ion in de verbinding en het wordt altijd het eerst geschreven in formules van ionische verbindingen. Controleer de periodetabel om de naam van "Na" te vinden als dat nodig is. na is natrium. Dus schrijf natrium.[3]
3 Schrijf de naam van het metaal. Het eerste deel van een ionische verbinding wordt het "kation" genoemd, wat een metaal is. Dit is het positief geladen ion in de verbinding en het wordt altijd het eerst geschreven in formules van ionische verbindingen. Controleer de periodetabel om de naam van "Na" te vinden als dat nodig is. na is natrium. Dus schrijf natrium.[3] - Ongeacht het soort ionische verbinding waar je mee te maken hebt, de naam van het metaal is altijd het eerst geschreven.
-
 4 Voeg de naam van het niet-metaal toe met een-einde. De tweede component van een ionische verbinding is het niet-metaalanion. Schrijf de naam van het niet-metaal met een "-id" -uitgang. cl is chloor. Voeg het "-ide" -einde toe door de 1 of 2 lettergrepen (in dit geval "-ine") te laten vallen en in plaats daarvan "-ide" toe te voegen. Chloor wordt chloride.[4]
4 Voeg de naam van het niet-metaal toe met een-einde. De tweede component van een ionische verbinding is het niet-metaalanion. Schrijf de naam van het niet-metaal met een "-id" -uitgang. cl is chloor. Voeg het "-ide" -einde toe door de 1 of 2 lettergrepen (in dit geval "-ine") te laten vallen en in plaats daarvan "-ide" toe te voegen. Chloor wordt chloride.[4] - Dit naamgevingsprincipe is ook van toepassing op andere anionen. In een ionische verbinding bijvoorbeeld, wordt "Fosfor" "Fosfide" en wordt "Jodium" "Jodide".
-
 5 Combineer de kation- en anionamen. Zodra je de namen voor de 2 componenten van de ionische verbinding hebt gevonden, heb je bijna al het werk gedaan. Nu moet je gewoon de onderdelen samenvoegen. NaCl kan als worden geschreven natriumchloride.[5]
5 Combineer de kation- en anionamen. Zodra je de namen voor de 2 componenten van de ionische verbinding hebt gevonden, heb je bijna al het werk gedaan. Nu moet je gewoon de onderdelen samenvoegen. NaCl kan als worden geschreven natriumchloride.[5] -
 6 Oefen met het benoemen van meer eenvoudige ionische verbindingen. Als je eenmaal weet hoe je deze ionische verbinding moet noemen, probeer dan een paar eenvoudige ionische verbindingen te benoemen. Het onthouden van een paar veel voorkomende ionische verbindingen kan u helpen een beter begrip te krijgen van de naamgeving van ionische verbindingen. Vergeet niet dat u zich geen zorgen hoeft te maken over het aantal individuele ionen bij het benoemen van de verbindingen. Hier zijn een paar meer voorkomende ionische verbindingen:
6 Oefen met het benoemen van meer eenvoudige ionische verbindingen. Als je eenmaal weet hoe je deze ionische verbinding moet noemen, probeer dan een paar eenvoudige ionische verbindingen te benoemen. Het onthouden van een paar veel voorkomende ionische verbindingen kan u helpen een beter begrip te krijgen van de naamgeving van ionische verbindingen. Vergeet niet dat u zich geen zorgen hoeft te maken over het aantal individuele ionen bij het benoemen van de verbindingen. Hier zijn een paar meer voorkomende ionische verbindingen: - Li2S = Lithiumsulfide
- ag2S = Zilver sulfide
- MgCl2 = Magnesium chloride
Methode twee van drie:
Ionische verbindingen benoemen met Transition Metals
-
 1 Noteer de formule van de ionische verbinding. Stel bijvoorbeeld dat u met deze stof werkt: Fe2O3. Overgangsmetalen zijn te vinden in het midden van de periodieke tabellen en omvatten metalen zoals platina, goud en zirkonium. Om dit te verklaren in de naam van de ionische verbinding, moet je een Romeins cijfer invoegen.[6]
1 Noteer de formule van de ionische verbinding. Stel bijvoorbeeld dat u met deze stof werkt: Fe2O3. Overgangsmetalen zijn te vinden in het midden van de periodieke tabellen en omvatten metalen zoals platina, goud en zirkonium. Om dit te verklaren in de naam van de ionische verbinding, moet je een Romeins cijfer invoegen.[6] - Overgangsmetalen nemen in ionische verbindingen wat meer werk in beslag, omdat hun oxidatienummers (of hun ladingen) voortdurend veranderen.
- 2 Ontdek de lading van het metaal. Als je metaal uit groep 3 (of hoger) in het periodiek systeem komt, moet je de lading ervan berekenen. Het subscriptgetal van het anion waarmee het metaal gepaard is, geeft de lading van een overgangsmetaal aan.[7] Metalen hebben een positieve lading, dus in dit geval steek je de 3 over van de O3 en schrijf dat Fe heeft een toeslag van +3.
- Je kunt ook het omgekeerde doen en dat schrijven O heeft een lading van -2.
- In veel scheikundeopdrachten op de middelbare school of op universitair niveau wordt de lading van het metaal voor jou voorzien.
-
 3 Geef het metaal een naam en voeg zo nodig een Romeins cijfer toe. Raadpleeg het periodiek systeem als je wilt weten wat de chemische code is voor het metaal waarmee je te maken hebt. Sinds Fe is ijzer en het heeft een lading van +3, je kunt opschrijven IJzer (III).[8]
3 Geef het metaal een naam en voeg zo nodig een Romeins cijfer toe. Raadpleeg het periodiek systeem als je wilt weten wat de chemische code is voor het metaal waarmee je te maken hebt. Sinds Fe is ijzer en het heeft een lading van +3, je kunt opschrijven IJzer (III).[8] - Denk eraan om alleen het Romeinse cijfer te gebruiken wanneer u de naam van het ionische bestanddeel op schrift schrijft en niet wanneer u de formule schrijft.
-
 4 Noem het niet-metaal door het achtervoegsel te herzien. Raadpleeg het periodiek systeem als u de anionnaam bent vergeten. Sinds O is zuurstof, je kunt het "-gen" einde laten vallen en het "-ide" einde toevoegen. Noem het "oxide".[9]
4 Noem het niet-metaal door het achtervoegsel te herzien. Raadpleeg het periodiek systeem als u de anionnaam bent vergeten. Sinds O is zuurstof, je kunt het "-gen" einde laten vallen en het "-ide" einde toevoegen. Noem het "oxide".[9] - Anionen nemen altijd het achtervoegsel -ide. U noemt anionen dus hetzelfde, ongeacht het type metaal waarmee ze in een ionische verbinding zijn gepaard.
-
 5 Combineer de namen om de naam van de ionische verbinding te genereren. Dit deel verschilt niet van het uitschrijven van de naam van een ionische verbinding die geen overgangsmetaal heeft. Combineer de metalen en niet-metalen namen (inclusief Romeins cijfer) om de ionische verbinding te noemen: Fe2O3 = IJzer (III) oxide.[10]
5 Combineer de namen om de naam van de ionische verbinding te genereren. Dit deel verschilt niet van het uitschrijven van de naam van een ionische verbinding die geen overgangsmetaal heeft. Combineer de metalen en niet-metalen namen (inclusief Romeins cijfer) om de ionische verbinding te noemen: Fe2O3 = IJzer (III) oxide.[10] -
 6 Gebruik de oudere naamgevingsmethode in plaats van Romeinse cijfers. Onder de oudere naamgevingsmethode, gebruikt u "-achtige" en "-achtige" eindes voor overgangsmetalen in plaats van de Romeinse cijfers. Kijk naar de 2 ionische componenten van de verbinding. Als het metaal een lagere numerieke lading heeft dan het niet-metaal, voeg je het "-achtige" einde toe. Als het metaal een hogere lading heeft, voeg dan een "-achtig" einde toe.[11]
6 Gebruik de oudere naamgevingsmethode in plaats van Romeinse cijfers. Onder de oudere naamgevingsmethode, gebruikt u "-achtige" en "-achtige" eindes voor overgangsmetalen in plaats van de Romeinse cijfers. Kijk naar de 2 ionische componenten van de verbinding. Als het metaal een lagere numerieke lading heeft dan het niet-metaal, voeg je het "-achtige" einde toe. Als het metaal een hogere lading heeft, voeg dan een "-achtig" einde toe.[11] - Fe2+ heeft de lagere toestand dan zuurstof (Fe3+ heeft de hogere staat), dus "Fe" wordt ferro. De naam van Fe2+O kan ook worden geschreven als ijzeroxide.
- De termen "ijzer" en "ijzerhoudend" zijn beide te gebruiken om te verwijzen naar ionen die ijzer bevatten, omdat het symbool van ijzer "Fe" is.
- 7 Gebruik geen Romeinse cijfers bij het benoemen van verbindingen met zink of zilver. De twee overgangsmetalen die wel een duidelijke lading hebben, zijn zink (Zn) en zilver (Ag). Dus, de lading van het metaal in ionische verbindingen met zink of zilver hoeft niet te worden geleend van het subscript van het anion. Zink heeft altijd een lading van +2 en zilver heeft altijd een lading van +1.[12]
- Dit betekent dat u bij het beschrijven van die elementen geen Romeinse cijfers of de oudere naamgevingsmethode hoeft te gebruiken.
Methode drie van drie:
Ionische verbindingen benoemen met polyatomaire ionen
-
 1 Schrijf de formule voor het polyatomaire ion. Polyatomische ionische verbindingen bevatten meer dan 2 ionen. In de meeste polyatomaire verbindingen zal 1 ion metaal zijn en de rest niet-metalen. Raadpleeg zoals altijd het periodieke systeem om de namen van elke ion te vinden. Laten we zeggen dat je met de volgende verbinding werkt: FeNH4(ZO4)2.[13]
1 Schrijf de formule voor het polyatomaire ion. Polyatomische ionische verbindingen bevatten meer dan 2 ionen. In de meeste polyatomaire verbindingen zal 1 ion metaal zijn en de rest niet-metalen. Raadpleeg zoals altijd het periodieke systeem om de namen van elke ion te vinden. Laten we zeggen dat je met de volgende verbinding werkt: FeNH4(ZO4)2.[13] -
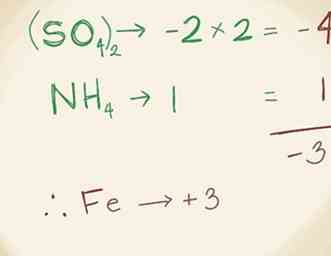 2 Vind de lading van het metaal. Eerst de SO4 ion heeft een lading van -2. Je weet ook dat er twee van deze ionen zijn vanwege de "2" onder de haakjes. Dit ion wordt "sulfaat" genoemd omdat het een combinatie is van zuurstof en zwavel. Dus 2 x -2 = -4. Dan is het NH4of het ammoniumion heeft een lading van +1. Je kunt erachter komen dat het deze positieve lading heeft, omdat ammoniak zelf neutraal is en ammonium 1 extra waterstofmolecuul bevat. (Ammonium wordt zo genoemd omdat het 1 stikstofmolecuul combineert met 4 waterstofmoleculen.) Voeg -4 en 1 toe en je krijgt -3. Dit betekent dat het ijzerion, Fe, een lading van +3 moet hebben om het goed te maken en om de verbinding neutraal te maken.[14]
2 Vind de lading van het metaal. Eerst de SO4 ion heeft een lading van -2. Je weet ook dat er twee van deze ionen zijn vanwege de "2" onder de haakjes. Dit ion wordt "sulfaat" genoemd omdat het een combinatie is van zuurstof en zwavel. Dus 2 x -2 = -4. Dan is het NH4of het ammoniumion heeft een lading van +1. Je kunt erachter komen dat het deze positieve lading heeft, omdat ammoniak zelf neutraal is en ammonium 1 extra waterstofmolecuul bevat. (Ammonium wordt zo genoemd omdat het 1 stikstofmolecuul combineert met 4 waterstofmoleculen.) Voeg -4 en 1 toe en je krijgt -3. Dit betekent dat het ijzerion, Fe, een lading van +3 moet hebben om het goed te maken en om de verbinding neutraal te maken.[14] - Ionische verbindingen hebben altijd een neutrale lading. U kunt deze informatie gebruiken om de lading van het metaal te berekenen.
- ZO4 heeft een lading van -2 omdat het negatief is zonder de 2 waterstofatomen die het had toen het als zwavelzuur bestond.[15]
-
 3 Noem de metaalionen. De manier waarop u de naam schrijft, is afhankelijk van of u de nieuwere of oudere naamgevingsmethode gebruikt. Dus, om het metaalion te noemen, schrijf IJzer (III) of ijzer.
3 Noem de metaalionen. De manier waarop u de naam schrijft, is afhankelijk van of u de nieuwere of oudere naamgevingsmethode gebruikt. Dus, om het metaalion te noemen, schrijf IJzer (III) of ijzer. -
 4 Noteer de naam van de niet-metaalionen. Raadpleeg het periodiek systeem om uzelf eraan te herinneren dat "S" zwavel is. Ammonium is geen element, maar treedt op wanneer 1 stikstofion combineert met 4 waterstofionen. Dus je werkt mee ammonium en sulfaat, of ammoniumsulfaat.
4 Noteer de naam van de niet-metaalionen. Raadpleeg het periodiek systeem om uzelf eraan te herinneren dat "S" zwavel is. Ammonium is geen element, maar treedt op wanneer 1 stikstofion combineert met 4 waterstofionen. Dus je werkt mee ammonium en sulfaat, of ammoniumsulfaat. - "Ammoniak" wordt "ammonium" als het een positieve lading krijgt. Ammonia zelf is neutraal geladen.
-
 5 Combineer de naam van het metaal met de namen van de niet-metalen. Je kunt de samengestelde FeNH een naam geven4(ZO4)2 door te schrijven ijzer (III) ammoniumsulfaat.[16]
5 Combineer de naam van het metaal met de namen van de niet-metalen. Je kunt de samengestelde FeNH een naam geven4(ZO4)2 door te schrijven ijzer (III) ammoniumsulfaat.[16] - Als u de oudere naamgevingsmethode voor ionische verbindingen moet gebruiken, schrijft u ijzer (III) ammoniumsulfaat.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 2 Noteer de formule van de ionische verbinding. Laten we zeggen dat de ionische verbinding waarmee u werkt is NaCl. Gebruik een pen of potlood om dit op een vel papier op te schrijven. Of, als u in een klaslokaal werkt, schrijft u "NaCl" op het whiteboard.
2 Noteer de formule van de ionische verbinding. Laten we zeggen dat de ionische verbinding waarmee u werkt is NaCl. Gebruik een pen of potlood om dit op een vel papier op te schrijven. Of, als u in een klaslokaal werkt, schrijft u "NaCl" op het whiteboard.  3 Schrijf de naam van het metaal. Het eerste deel van een ionische verbinding wordt het "kation" genoemd, wat een metaal is. Dit is het positief geladen ion in de verbinding en het wordt altijd het eerst geschreven in formules van ionische verbindingen. Controleer de periodetabel om de naam van "Na" te vinden als dat nodig is. na is natrium. Dus schrijf natrium.[3]
3 Schrijf de naam van het metaal. Het eerste deel van een ionische verbinding wordt het "kation" genoemd, wat een metaal is. Dit is het positief geladen ion in de verbinding en het wordt altijd het eerst geschreven in formules van ionische verbindingen. Controleer de periodetabel om de naam van "Na" te vinden als dat nodig is. na is natrium. Dus schrijf natrium.[3]  4 Voeg de naam van het niet-metaal toe met een-einde. De tweede component van een ionische verbinding is het niet-metaalanion. Schrijf de naam van het niet-metaal met een "-id" -uitgang. cl is chloor. Voeg het "-ide" -einde toe door de 1 of 2 lettergrepen (in dit geval "-ine") te laten vallen en in plaats daarvan "-ide" toe te voegen. Chloor wordt chloride.[4]
4 Voeg de naam van het niet-metaal toe met een-einde. De tweede component van een ionische verbinding is het niet-metaalanion. Schrijf de naam van het niet-metaal met een "-id" -uitgang. cl is chloor. Voeg het "-ide" -einde toe door de 1 of 2 lettergrepen (in dit geval "-ine") te laten vallen en in plaats daarvan "-ide" toe te voegen. Chloor wordt chloride.[4]  5 Combineer de kation- en anionamen. Zodra je de namen voor de 2 componenten van de ionische verbinding hebt gevonden, heb je bijna al het werk gedaan. Nu moet je gewoon de onderdelen samenvoegen. NaCl kan als worden geschreven natriumchloride.[5]
5 Combineer de kation- en anionamen. Zodra je de namen voor de 2 componenten van de ionische verbinding hebt gevonden, heb je bijna al het werk gedaan. Nu moet je gewoon de onderdelen samenvoegen. NaCl kan als worden geschreven natriumchloride.[5]  6 Oefen met het benoemen van meer eenvoudige ionische verbindingen. Als je eenmaal weet hoe je deze ionische verbinding moet noemen, probeer dan een paar eenvoudige ionische verbindingen te benoemen. Het onthouden van een paar veel voorkomende ionische verbindingen kan u helpen een beter begrip te krijgen van de naamgeving van ionische verbindingen. Vergeet niet dat u zich geen zorgen hoeft te maken over het aantal individuele ionen bij het benoemen van de verbindingen. Hier zijn een paar meer voorkomende ionische verbindingen:
6 Oefen met het benoemen van meer eenvoudige ionische verbindingen. Als je eenmaal weet hoe je deze ionische verbinding moet noemen, probeer dan een paar eenvoudige ionische verbindingen te benoemen. Het onthouden van een paar veel voorkomende ionische verbindingen kan u helpen een beter begrip te krijgen van de naamgeving van ionische verbindingen. Vergeet niet dat u zich geen zorgen hoeft te maken over het aantal individuele ionen bij het benoemen van de verbindingen. Hier zijn een paar meer voorkomende ionische verbindingen:  1 Noteer de formule van de ionische verbinding. Stel bijvoorbeeld dat u met deze stof werkt: Fe2O3. Overgangsmetalen zijn te vinden in het midden van de periodieke tabellen en omvatten metalen zoals platina, goud en zirkonium. Om dit te verklaren in de naam van de ionische verbinding, moet je een Romeins cijfer invoegen.[6]
1 Noteer de formule van de ionische verbinding. Stel bijvoorbeeld dat u met deze stof werkt: Fe2O3. Overgangsmetalen zijn te vinden in het midden van de periodieke tabellen en omvatten metalen zoals platina, goud en zirkonium. Om dit te verklaren in de naam van de ionische verbinding, moet je een Romeins cijfer invoegen.[6]  3 Geef het metaal een naam en voeg zo nodig een Romeins cijfer toe. Raadpleeg het periodiek systeem als je wilt weten wat de chemische code is voor het metaal waarmee je te maken hebt. Sinds Fe is ijzer en het heeft een lading van +3, je kunt opschrijven IJzer (III).[8]
3 Geef het metaal een naam en voeg zo nodig een Romeins cijfer toe. Raadpleeg het periodiek systeem als je wilt weten wat de chemische code is voor het metaal waarmee je te maken hebt. Sinds Fe is ijzer en het heeft een lading van +3, je kunt opschrijven IJzer (III).[8]  4 Noem het niet-metaal door het achtervoegsel te herzien. Raadpleeg het periodiek systeem als u de anionnaam bent vergeten. Sinds O is zuurstof, je kunt het "-gen" einde laten vallen en het "-ide" einde toevoegen. Noem het "oxide".[9]
4 Noem het niet-metaal door het achtervoegsel te herzien. Raadpleeg het periodiek systeem als u de anionnaam bent vergeten. Sinds O is zuurstof, je kunt het "-gen" einde laten vallen en het "-ide" einde toevoegen. Noem het "oxide".[9]  5 Combineer de namen om de naam van de ionische verbinding te genereren. Dit deel verschilt niet van het uitschrijven van de naam van een ionische verbinding die geen overgangsmetaal heeft. Combineer de metalen en niet-metalen namen (inclusief Romeins cijfer) om de ionische verbinding te noemen: Fe2O3 = IJzer (III) oxide.[10]
5 Combineer de namen om de naam van de ionische verbinding te genereren. Dit deel verschilt niet van het uitschrijven van de naam van een ionische verbinding die geen overgangsmetaal heeft. Combineer de metalen en niet-metalen namen (inclusief Romeins cijfer) om de ionische verbinding te noemen: Fe2O3 = IJzer (III) oxide.[10]  6 Gebruik de oudere naamgevingsmethode in plaats van Romeinse cijfers. Onder de oudere naamgevingsmethode, gebruikt u "-achtige" en "-achtige" eindes voor overgangsmetalen in plaats van de Romeinse cijfers. Kijk naar de 2 ionische componenten van de verbinding. Als het metaal een lagere numerieke lading heeft dan het niet-metaal, voeg je het "-achtige" einde toe. Als het metaal een hogere lading heeft, voeg dan een "-achtig" einde toe.[11]
6 Gebruik de oudere naamgevingsmethode in plaats van Romeinse cijfers. Onder de oudere naamgevingsmethode, gebruikt u "-achtige" en "-achtige" eindes voor overgangsmetalen in plaats van de Romeinse cijfers. Kijk naar de 2 ionische componenten van de verbinding. Als het metaal een lagere numerieke lading heeft dan het niet-metaal, voeg je het "-achtige" einde toe. Als het metaal een hogere lading heeft, voeg dan een "-achtig" einde toe.[11]  1 Schrijf de formule voor het polyatomaire ion. Polyatomische ionische verbindingen bevatten meer dan 2 ionen. In de meeste polyatomaire verbindingen zal 1 ion metaal zijn en de rest niet-metalen. Raadpleeg zoals altijd het periodieke systeem om de namen van elke ion te vinden. Laten we zeggen dat je met de volgende verbinding werkt: FeNH4(ZO4)2.[13]
1 Schrijf de formule voor het polyatomaire ion. Polyatomische ionische verbindingen bevatten meer dan 2 ionen. In de meeste polyatomaire verbindingen zal 1 ion metaal zijn en de rest niet-metalen. Raadpleeg zoals altijd het periodieke systeem om de namen van elke ion te vinden. Laten we zeggen dat je met de volgende verbinding werkt: FeNH4(ZO4)2.[13] 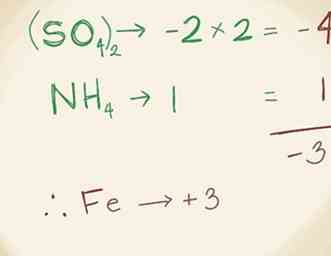 2 Vind de lading van het metaal. Eerst de SO4 ion heeft een lading van -2. Je weet ook dat er twee van deze ionen zijn vanwege de "2" onder de haakjes. Dit ion wordt "sulfaat" genoemd omdat het een combinatie is van zuurstof en zwavel. Dus 2 x -2 = -4. Dan is het NH4of het ammoniumion heeft een lading van +1. Je kunt erachter komen dat het deze positieve lading heeft, omdat ammoniak zelf neutraal is en ammonium 1 extra waterstofmolecuul bevat. (Ammonium wordt zo genoemd omdat het 1 stikstofmolecuul combineert met 4 waterstofmoleculen.) Voeg -4 en 1 toe en je krijgt -3. Dit betekent dat het ijzerion, Fe, een lading van +3 moet hebben om het goed te maken en om de verbinding neutraal te maken.[14]
2 Vind de lading van het metaal. Eerst de SO4 ion heeft een lading van -2. Je weet ook dat er twee van deze ionen zijn vanwege de "2" onder de haakjes. Dit ion wordt "sulfaat" genoemd omdat het een combinatie is van zuurstof en zwavel. Dus 2 x -2 = -4. Dan is het NH4of het ammoniumion heeft een lading van +1. Je kunt erachter komen dat het deze positieve lading heeft, omdat ammoniak zelf neutraal is en ammonium 1 extra waterstofmolecuul bevat. (Ammonium wordt zo genoemd omdat het 1 stikstofmolecuul combineert met 4 waterstofmoleculen.) Voeg -4 en 1 toe en je krijgt -3. Dit betekent dat het ijzerion, Fe, een lading van +3 moet hebben om het goed te maken en om de verbinding neutraal te maken.[14]  3 Noem de metaalionen. De manier waarop u de naam schrijft, is afhankelijk van of u de nieuwere of oudere naamgevingsmethode gebruikt. Dus, om het metaalion te noemen, schrijf IJzer (III) of ijzer.
3 Noem de metaalionen. De manier waarop u de naam schrijft, is afhankelijk van of u de nieuwere of oudere naamgevingsmethode gebruikt. Dus, om het metaalion te noemen, schrijf IJzer (III) of ijzer.  4 Noteer de naam van de niet-metaalionen. Raadpleeg het periodiek systeem om uzelf eraan te herinneren dat "S" zwavel is. Ammonium is geen element, maar treedt op wanneer 1 stikstofion combineert met 4 waterstofionen. Dus je werkt mee ammonium en sulfaat, of ammoniumsulfaat.
4 Noteer de naam van de niet-metaalionen. Raadpleeg het periodiek systeem om uzelf eraan te herinneren dat "S" zwavel is. Ammonium is geen element, maar treedt op wanneer 1 stikstofion combineert met 4 waterstofionen. Dus je werkt mee ammonium en sulfaat, of ammoniumsulfaat.  5 Combineer de naam van het metaal met de namen van de niet-metalen. Je kunt de samengestelde FeNH een naam geven4(ZO4)2 door te schrijven ijzer (III) ammoniumsulfaat.[16]
5 Combineer de naam van het metaal met de namen van de niet-metalen. Je kunt de samengestelde FeNH een naam geven4(ZO4)2 door te schrijven ijzer (III) ammoniumsulfaat.[16]