Hoewel je het waterpeil van een waterlichaam kunt laten stijgen door er meer massa aan toe te voegen (bijv. Meer water of een ander materiaal), is er een algemeen experiment ontworpen om water in een glas "op te laten stijgen". Met slechts een paar items kunt u de principes van Charles's Law (die stelt dat de temperatuur van gas recht evenredig is met het volume van het gas wanneer deze onder een constante druk staat) gebruiken om indruk te maken en een publiek te intrigeren met dit experiment.
Methode één van de drie:
Het experiment opzetten
-
 1 Vul een pan met water. De pan moet minstens 1-2 inch (2.5-5.1 cm) diep zijn. U hebt een pan nodig die voldoende water kan bevatten, zodat deze niet allemaal in het glas wordt opgezogen. Als al het water in het glas wordt opgezogen, kan er lucht binnendringen. Aangezien het water zwaarder is dan de lucht, zal het door zwaartekracht weer uit het glas vallen.[1]
1 Vul een pan met water. De pan moet minstens 1-2 inch (2.5-5.1 cm) diep zijn. U hebt een pan nodig die voldoende water kan bevatten, zodat deze niet allemaal in het glas wordt opgezogen. Als al het water in het glas wordt opgezogen, kan er lucht binnendringen. Aangezien het water zwaarder is dan de lucht, zal het door zwaartekracht weer uit het glas vallen.[1] -
 2 Voeg desgewenst kleurstof aan het water toe. De kleurstof van het voedsel draagt helemaal niet bij aan de wetenschap. Het maakt het water echter gemakkelijker te zien als het in het glas stijgt. Dit is vooral belangrijk voor een groot publiek dat mogelijk niet dicht bij het glas kan komen.[2]
2 Voeg desgewenst kleurstof aan het water toe. De kleurstof van het voedsel draagt helemaal niet bij aan de wetenschap. Het maakt het water echter gemakkelijker te zien als het in het glas stijgt. Dit is vooral belangrijk voor een groot publiek dat mogelijk niet dicht bij het glas kan komen.[2] -
 3 Verzamel alle andere benodigde materialen. Zorg ervoor dat je een glas, een kaars en een aansteker of lucifer hebt voordat je begint. Het maakt niet uit wat voor soort lucifer of aansteker je gebruikt. Je moet een glas gebruiken en geen plastic bekertje. Het gebruik van een korte kaars zorgt er ook voor dat de vlam niet direct in aanraking komt met het glas, maar de kaars moet lang genoeg zijn zodat de pit niet nat wordt als u hem in de pan water legt.
3 Verzamel alle andere benodigde materialen. Zorg ervoor dat je een glas, een kaars en een aansteker of lucifer hebt voordat je begint. Het maakt niet uit wat voor soort lucifer of aansteker je gebruikt. Je moet een glas gebruiken en geen plastic bekertje. Het gebruik van een korte kaars zorgt er ook voor dat de vlam niet direct in aanraking komt met het glas, maar de kaars moet lang genoeg zijn zodat de pit niet nat wordt als u hem in de pan water legt. - Als u een glas probeert te vervangen door een plastic beker, smelt het en mislukt het experiment.
- Theelichtkaarsen werken goed voor dit experiment.
Methode twee van drie:
De waterstijging in het glas maken
-
 1 Doe de kaars in de pan met water. Zorg ervoor dat je de pit niet nat krijgt. Steek de kaars aan in het midden van de pan met water.[3]
1 Doe de kaars in de pan met water. Zorg ervoor dat je de pit niet nat krijgt. Steek de kaars aan in het midden van de pan met water.[3] - Als u een theelichtkaars gebruikt, zal deze alleen in de pan zitten. Als u een lange, dunne kaars gebruikt, kan deze kantelen. Om dit te voorkomen, gebruikt u een korte kaarsenhouder om de kaars te stabiliseren.
-
 2 Plaats het glas over de kaars. Draai het glas ondersteboven en plaats het boven de kaars. Zorg ervoor dat de opening van het glas volledig in het water is ondergedompeld. Dit zorgt voor een afdichting die voorkomt dat lucht het glas binnendringt en het water in het glas laat rijzen.[4]
2 Plaats het glas over de kaars. Draai het glas ondersteboven en plaats het boven de kaars. Zorg ervoor dat de opening van het glas volledig in het water is ondergedompeld. Dit zorgt voor een afdichting die voorkomt dat lucht het glas binnendringt en het water in het glas laat rijzen.[4] - Als de kaars het glas aanraakt, kunt u een kortere kaars of een groter glas krijgen. Dit zorgt ervoor dat het experiment goed verloopt.
-
 3 Kijk uit voor bubbels. Terwijl de kaars brandt, verwarmt deze het gas in het glas. Hierdoor zal het gas uitzetten en de druk in het glas verhogen. Wat gas zal uit het glas moeten ontsnappen om de druk te verlichten. De enige manier om gas te laten ontsnappen, is door het water op de bodem van het glas. Zodra de druk hoog genoeg is, heeft het gas geen andere keus dan door het water te bubbelen. [5]
3 Kijk uit voor bubbels. Terwijl de kaars brandt, verwarmt deze het gas in het glas. Hierdoor zal het gas uitzetten en de druk in het glas verhogen. Wat gas zal uit het glas moeten ontsnappen om de druk te verlichten. De enige manier om gas te laten ontsnappen, is door het water op de bodem van het glas. Zodra de druk hoog genoeg is, heeft het gas geen andere keus dan door het water te bubbelen. [5] -
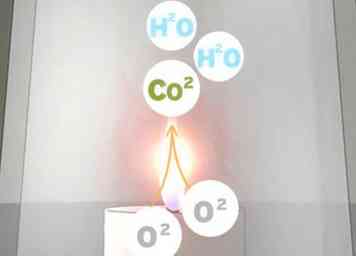
 4 Laat de kaars uitbranden. De brandende kaars zet 2 zuurstofmoleculen (2O2) en 1 molecuul paraffinewas (CH4) tot 1 koolstofdioxidemolecuul (CO2) en 2 watermoleculen (2H2O). Zonder dat er lucht in het glas komt, zal de kaars alle beschikbare zuurstof verbranden. Wanneer de zuurstof op is, kan het vuur op de kaars niet meer branden.[6]
4 Laat de kaars uitbranden. De brandende kaars zet 2 zuurstofmoleculen (2O2) en 1 molecuul paraffinewas (CH4) tot 1 koolstofdioxidemolecuul (CO2) en 2 watermoleculen (2H2O). Zonder dat er lucht in het glas komt, zal de kaars alle beschikbare zuurstof verbranden. Wanneer de zuurstof op is, kan het vuur op de kaars niet meer branden.[6] - Hoewel er mogelijk zuurstof in het glas achterblijft, gaat de kaars uit wanneer deze alle zuurstof heeft opgebruikt die zich dicht genoeg bij de vlam bevindt.
-
 5 Zie hoe het water in het glas oprijst. Wanneer de kaars uitbrandt, zal het resterende gas snel afkoelen. Het koelgas samentrekt (krimpt het volume) en creëert een vacuüm in het glas. De externe druk zal het water in het glas dwingen om het vacuüm te vullen.[7]
5 Zie hoe het water in het glas oprijst. Wanneer de kaars uitbrandt, zal het resterende gas snel afkoelen. Het koelgas samentrekt (krimpt het volume) en creëert een vacuüm in het glas. De externe druk zal het water in het glas dwingen om het vacuüm te vullen.[7] - Dit is gemakkelijker te zien als u ervoor kiest het water in te kleuren met voedselkleuring. Houd er rekening mee dat het water slechts een deel van het glas zal vullen, omdat er nog steeds gas in het glas zit.
Methode drie van drie:
Begrijpen waarom het water in het glas stijgt
-
 1 Weet welke chemische reactie er plaatsvindt. Er zijn veel onjuiste verklaringen voor dit experiment. Om te begrijpen wat er echt aan de hand is, moet je weten wat chemie is. De optredende verbrandingsreactie is:[8]
1 Weet welke chemische reactie er plaatsvindt. Er zijn veel onjuiste verklaringen voor dit experiment. Om te begrijpen wat er echt aan de hand is, moet je weten wat chemie is. De optredende verbrandingsreactie is:[8] - 2O2 + CH4 → Co2 + 2H2O
-
 2 Denk aan Charles's wet. Charles's wet is een stuk van de ideale gaswet die zegt dat het volume van een gas evenredig zal veranderen met de temperatuur (en vice versa) wanneer de externe druk en de massa van het gas constant blijven. Omdat de wanden van het glas de hoeveelheid druk die ze op het inwendige gas uitoefenen niet veranderen, blijft de druk in dit experiment constant. Het gas kan het glas niet ingaan omdat het ondersteboven in het water zit, waardoor een verzegeling ontstaat.
2 Denk aan Charles's wet. Charles's wet is een stuk van de ideale gaswet die zegt dat het volume van een gas evenredig zal veranderen met de temperatuur (en vice versa) wanneer de externe druk en de massa van het gas constant blijven. Omdat de wanden van het glas de hoeveelheid druk die ze op het inwendige gas uitoefenen niet veranderen, blijft de druk in dit experiment constant. Het gas kan het glas niet ingaan omdat het ondersteboven in het water zit, waardoor een verzegeling ontstaat. - Technisch gezien, omdat de verbrandingsreactie 2 O omzet2 moleculen in 1 CO2 en 2 H2O-moleculen, de hoeveelheid gas neemt tijdelijk toe. De kaars houdt de temperatuur in het glas echter niet boven 100 ° C (212 ° F) en de 2 H2O-moleculen zullen condenseren tot vloeibaar water. Dit betekent dat de hoeveelheid gas in het glas effectief afneemt terwijl de kaars brandt.[9]
- Charles's wet is in dit geval alleen van toepassing omdat de hoeveelheid gas in het glas constant blijft vanaf het moment dat de kaars uitbrandt. Zonder de verbranding wordt geen gas meer verbruikt of geproduceerd. De warmtebron verdwijnt tegelijkertijd, waardoor het gas kan afkoelen en in volume afnemen.[10]
-
 3 Overweeg wat er gebeurt als het gas afkoelt. Omdat het volume van het gas evenredig is met de temperatuur, neemt het af naarmate het gas afkoelt. Deze afname in volume creëert een vacuüm in het glas. De druk buiten het glas blijft hetzelfde, dus dit creëert een drukverschil.[11]
3 Overweeg wat er gebeurt als het gas afkoelt. Omdat het volume van het gas evenredig is met de temperatuur, neemt het af naarmate het gas afkoelt. Deze afname in volume creëert een vacuüm in het glas. De druk buiten het glas blijft hetzelfde, dus dit creëert een drukverschil.[11] -
 4 Begrijp drukverschillen. Binnen een bepaald systeem gaan vloeistoffen van het hogedrukuiteinde naar het lagedrukuiteinde. Met lucht die is afgedicht uit het glas, wordt het water vanaf het hogedrukuiteinde van het systeem (buiten het glas) naar het lagedrukuiteinde van het systeem (binnen in het glas) geduwd totdat de druk in het glas gelijk is aan de druk buiten het glas.[12]
4 Begrijp drukverschillen. Binnen een bepaald systeem gaan vloeistoffen van het hogedrukuiteinde naar het lagedrukuiteinde. Met lucht die is afgedicht uit het glas, wordt het water vanaf het hogedrukuiteinde van het systeem (buiten het glas) naar het lagedrukuiteinde van het systeem (binnen in het glas) geduwd totdat de druk in het glas gelijk is aan de druk buiten het glas.[12] - Dit lijkt een beetje op het openen van een kraan. De druk buiten de waterlijn is lager dan de druk in de leiding, dus wordt het water door de leiding en uit de kraan geforceerd (zelfs als het tegen de zwaartekracht in moet).
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Vul een pan met water. De pan moet minstens 1-2 inch (2.5-5.1 cm) diep zijn. U hebt een pan nodig die voldoende water kan bevatten, zodat deze niet allemaal in het glas wordt opgezogen. Als al het water in het glas wordt opgezogen, kan er lucht binnendringen. Aangezien het water zwaarder is dan de lucht, zal het door zwaartekracht weer uit het glas vallen.[1]
1 Vul een pan met water. De pan moet minstens 1-2 inch (2.5-5.1 cm) diep zijn. U hebt een pan nodig die voldoende water kan bevatten, zodat deze niet allemaal in het glas wordt opgezogen. Als al het water in het glas wordt opgezogen, kan er lucht binnendringen. Aangezien het water zwaarder is dan de lucht, zal het door zwaartekracht weer uit het glas vallen.[1]  2 Voeg desgewenst kleurstof aan het water toe. De kleurstof van het voedsel draagt helemaal niet bij aan de wetenschap. Het maakt het water echter gemakkelijker te zien als het in het glas stijgt. Dit is vooral belangrijk voor een groot publiek dat mogelijk niet dicht bij het glas kan komen.[2]
2 Voeg desgewenst kleurstof aan het water toe. De kleurstof van het voedsel draagt helemaal niet bij aan de wetenschap. Het maakt het water echter gemakkelijker te zien als het in het glas stijgt. Dit is vooral belangrijk voor een groot publiek dat mogelijk niet dicht bij het glas kan komen.[2]  3 Verzamel alle andere benodigde materialen. Zorg ervoor dat je een glas, een kaars en een aansteker of lucifer hebt voordat je begint. Het maakt niet uit wat voor soort lucifer of aansteker je gebruikt. Je moet een glas gebruiken en geen plastic bekertje. Het gebruik van een korte kaars zorgt er ook voor dat de vlam niet direct in aanraking komt met het glas, maar de kaars moet lang genoeg zijn zodat de pit niet nat wordt als u hem in de pan water legt.
3 Verzamel alle andere benodigde materialen. Zorg ervoor dat je een glas, een kaars en een aansteker of lucifer hebt voordat je begint. Het maakt niet uit wat voor soort lucifer of aansteker je gebruikt. Je moet een glas gebruiken en geen plastic bekertje. Het gebruik van een korte kaars zorgt er ook voor dat de vlam niet direct in aanraking komt met het glas, maar de kaars moet lang genoeg zijn zodat de pit niet nat wordt als u hem in de pan water legt.  1 Doe de kaars in de pan met water. Zorg ervoor dat je de pit niet nat krijgt. Steek de kaars aan in het midden van de pan met water.[3]
1 Doe de kaars in de pan met water. Zorg ervoor dat je de pit niet nat krijgt. Steek de kaars aan in het midden van de pan met water.[3]  2 Plaats het glas over de kaars. Draai het glas ondersteboven en plaats het boven de kaars. Zorg ervoor dat de opening van het glas volledig in het water is ondergedompeld. Dit zorgt voor een afdichting die voorkomt dat lucht het glas binnendringt en het water in het glas laat rijzen.[4]
2 Plaats het glas over de kaars. Draai het glas ondersteboven en plaats het boven de kaars. Zorg ervoor dat de opening van het glas volledig in het water is ondergedompeld. Dit zorgt voor een afdichting die voorkomt dat lucht het glas binnendringt en het water in het glas laat rijzen.[4]  3 Kijk uit voor bubbels. Terwijl de kaars brandt, verwarmt deze het gas in het glas. Hierdoor zal het gas uitzetten en de druk in het glas verhogen. Wat gas zal uit het glas moeten ontsnappen om de druk te verlichten. De enige manier om gas te laten ontsnappen, is door het water op de bodem van het glas. Zodra de druk hoog genoeg is, heeft het gas geen andere keus dan door het water te bubbelen. [5]
3 Kijk uit voor bubbels. Terwijl de kaars brandt, verwarmt deze het gas in het glas. Hierdoor zal het gas uitzetten en de druk in het glas verhogen. Wat gas zal uit het glas moeten ontsnappen om de druk te verlichten. De enige manier om gas te laten ontsnappen, is door het water op de bodem van het glas. Zodra de druk hoog genoeg is, heeft het gas geen andere keus dan door het water te bubbelen. [5]  4 Laat de kaars uitbranden. De brandende kaars zet 2 zuurstofmoleculen (2O2) en 1 molecuul paraffinewas (CH4) tot 1 koolstofdioxidemolecuul (CO2) en 2 watermoleculen (2H2O). Zonder dat er lucht in het glas komt, zal de kaars alle beschikbare zuurstof verbranden. Wanneer de zuurstof op is, kan het vuur op de kaars niet meer branden.[6]
4 Laat de kaars uitbranden. De brandende kaars zet 2 zuurstofmoleculen (2O2) en 1 molecuul paraffinewas (CH4) tot 1 koolstofdioxidemolecuul (CO2) en 2 watermoleculen (2H2O). Zonder dat er lucht in het glas komt, zal de kaars alle beschikbare zuurstof verbranden. Wanneer de zuurstof op is, kan het vuur op de kaars niet meer branden.[6]  5 Zie hoe het water in het glas oprijst. Wanneer de kaars uitbrandt, zal het resterende gas snel afkoelen. Het koelgas samentrekt (krimpt het volume) en creëert een vacuüm in het glas. De externe druk zal het water in het glas dwingen om het vacuüm te vullen.[7]
5 Zie hoe het water in het glas oprijst. Wanneer de kaars uitbrandt, zal het resterende gas snel afkoelen. Het koelgas samentrekt (krimpt het volume) en creëert een vacuüm in het glas. De externe druk zal het water in het glas dwingen om het vacuüm te vullen.[7]  1 Weet welke chemische reactie er plaatsvindt. Er zijn veel onjuiste verklaringen voor dit experiment. Om te begrijpen wat er echt aan de hand is, moet je weten wat chemie is. De optredende verbrandingsreactie is:[8]
1 Weet welke chemische reactie er plaatsvindt. Er zijn veel onjuiste verklaringen voor dit experiment. Om te begrijpen wat er echt aan de hand is, moet je weten wat chemie is. De optredende verbrandingsreactie is:[8]  2 Denk aan Charles's wet. Charles's wet is een stuk van de ideale gaswet die zegt dat het volume van een gas evenredig zal veranderen met de temperatuur (en vice versa) wanneer de externe druk en de massa van het gas constant blijven. Omdat de wanden van het glas de hoeveelheid druk die ze op het inwendige gas uitoefenen niet veranderen, blijft de druk in dit experiment constant. Het gas kan het glas niet ingaan omdat het ondersteboven in het water zit, waardoor een verzegeling ontstaat.
2 Denk aan Charles's wet. Charles's wet is een stuk van de ideale gaswet die zegt dat het volume van een gas evenredig zal veranderen met de temperatuur (en vice versa) wanneer de externe druk en de massa van het gas constant blijven. Omdat de wanden van het glas de hoeveelheid druk die ze op het inwendige gas uitoefenen niet veranderen, blijft de druk in dit experiment constant. Het gas kan het glas niet ingaan omdat het ondersteboven in het water zit, waardoor een verzegeling ontstaat.  3 Overweeg wat er gebeurt als het gas afkoelt. Omdat het volume van het gas evenredig is met de temperatuur, neemt het af naarmate het gas afkoelt. Deze afname in volume creëert een vacuüm in het glas. De druk buiten het glas blijft hetzelfde, dus dit creëert een drukverschil.[11]
3 Overweeg wat er gebeurt als het gas afkoelt. Omdat het volume van het gas evenredig is met de temperatuur, neemt het af naarmate het gas afkoelt. Deze afname in volume creëert een vacuüm in het glas. De druk buiten het glas blijft hetzelfde, dus dit creëert een drukverschil.[11]  4 Begrijp drukverschillen. Binnen een bepaald systeem gaan vloeistoffen van het hogedrukuiteinde naar het lagedrukuiteinde. Met lucht die is afgedicht uit het glas, wordt het water vanaf het hogedrukuiteinde van het systeem (buiten het glas) naar het lagedrukuiteinde van het systeem (binnen in het glas) geduwd totdat de druk in het glas gelijk is aan de druk buiten het glas.[12]
4 Begrijp drukverschillen. Binnen een bepaald systeem gaan vloeistoffen van het hogedrukuiteinde naar het lagedrukuiteinde. Met lucht die is afgedicht uit het glas, wordt het water vanaf het hogedrukuiteinde van het systeem (buiten het glas) naar het lagedrukuiteinde van het systeem (binnen in het glas) geduwd totdat de druk in het glas gelijk is aan de druk buiten het glas.[12]