Corrosie is het proces waarbij metaal degradeert in de aanwezigheid van verschillende oxidatiemiddelen in de omgeving. Een bekend voorbeeld hiervan is het proces van roesten, waarbij zich ijzeroxiden vormen in aanwezigheid van vocht. Corrosie is een serieus probleem voor de makers van gebouwen, boten, vliegtuigen, auto's en de meeste andere metalen producten. Wanneer bijvoorbeeld metaal wordt gebruikt als onderdeel van een brug, is de structurele integriteit van dat metaal, dat kan worden aangetast door corrosie, cruciaal voor de veiligheid van de mensen die de brug gebruiken. Zie stap 1 hieronder om te leren hoe u metalen kunt beschermen tegen corrosiegevaar en hoe u de onderstaande corrosiesnelheid kunt vertragen
Methode één van de drie:
Algemene soorten metaalcorrosie begrijpen
Omdat tegenwoordig zoveel verschillende soorten metaal in gebruik zijn, moeten bouwers en fabrikanten beschermen tegen veel verschillende soorten corrosie. Elk metaal heeft zijn eigen unieke elektrochemische eigenschappen die bepalen welke soorten corrosie (indien aanwezig) het metaal kwetsbaar is. De onderstaande tabel geeft een overzicht van een selectie van gewone metalen en de soorten corrosie die ze kunnen ondergaan.
| Metaal | Metal's Corrosion Kwetsbaarheid (en) | Common Preventative Techniques | Galvanische activiteit * |
|---|---|---|---|
| Roestvrij staal (passief) | Uniforme aanval, galvanisch, putcorrosie, spleet (vooral in zout water)[1] | Reiniging, beschermende coating of kit | Laag (initiële corrosie vormt resistente oxidelaag) |
| Ijzer | Uniforme aanval, galvanisch, spleet | Reiniging, beschermende coating of kit, galvanisatie, roestwerende solventen[2] | hoog |
| Messing | Eenvormige aanval, ontzinning, stress | Reiniging, beschermende coating of afdichtmiddel (meestal olie of lak), tin, aluminium of arseen toevoegen aan legering[3] | Medium |
| Aluminium | Galvanisch, putcorrosie, spleet[4] | Reiniging, beschermende coating of kit, anodiseren, galvaniseren, kathodische bescherming, elektrische isolatie [5] | Hoog (aanvankelijke corrosie vormt resistente oxidelaag) |
| Koper | Galvanisch, putcorrosie, esthetisch aanslag | Reiniging, beschermende coating of kit, nikkel toevoegen aan legering (vooral voor zout water) | Laag (initiële corrosie vormt resistente patina) |
* Merk op dat de kolom "Galvanische activiteit" verwijst naar de relatieve chemische activiteit van het metaal zoals beschreven door galvanische serietabellen uit referentiebronnen.[6] Voor de doeleinden van deze tabel hoe hoger de galvanische activiteit van het metaal, des te sneller zal het galvanische corrosie ondergaan wanneer het wordt samengevoegd met een minder actief metaal.
-
 1 Voorkom uniforme aantastingscorrosie door het metaaloppervlak te beschermen. Uniforme aanvalscorrosie (soms verkort tot "uniforme" corrosie) is een type corrosie dat, op passende wijze, op uniforme wijze optreedt over een blootliggend metalen oppervlak. Bij dit type corrosie wordt het gehele oppervlak van het metaal door corrosie aangetast en dus gaat de corrosie met een uniforme snelheid voort. Als een onbeschermd ijzeren dak bijvoorbeeld regelmatig wordt blootgesteld aan regen, zal het hele dakoppervlak in contact komen met ongeveer dezelfde hoeveelheid water en zal het dus in dezelfde mate corroderen. De eenvoudigste manier om te beschermen tegen uniforme aanvalscorrosie is meestal om een beschermende barrière te plaatsen tussen het metaal en de corroderende stoffen.[7] Dit kan een breed scala aan dingen zijn - verf, een oliekit, of een elektrochemische oplossing zoals een gegalvaniseerde zinklaag.
1 Voorkom uniforme aantastingscorrosie door het metaaloppervlak te beschermen. Uniforme aanvalscorrosie (soms verkort tot "uniforme" corrosie) is een type corrosie dat, op passende wijze, op uniforme wijze optreedt over een blootliggend metalen oppervlak. Bij dit type corrosie wordt het gehele oppervlak van het metaal door corrosie aangetast en dus gaat de corrosie met een uniforme snelheid voort. Als een onbeschermd ijzeren dak bijvoorbeeld regelmatig wordt blootgesteld aan regen, zal het hele dakoppervlak in contact komen met ongeveer dezelfde hoeveelheid water en zal het dus in dezelfde mate corroderen. De eenvoudigste manier om te beschermen tegen uniforme aanvalscorrosie is meestal om een beschermende barrière te plaatsen tussen het metaal en de corroderende stoffen.[7] Dit kan een breed scala aan dingen zijn - verf, een oliekit, of een elektrochemische oplossing zoals een gegalvaniseerde zinklaag. - In ondergrondse of onderdompelingssituaties is kathodische bescherming ook een goede keuze.[8]
-
 2 Voorkom galvanische corrosie door de ionenstroom van het ene metaal naar het andere te stoppen. Een belangrijke vorm van corrosie die kan optreden ongeacht de fysieke sterkte van de betrokken metalen is galvanische corrosie. Galvanische corrosie treedt op wanneer twee metalen met verschillende elektrodenpotentialen in contact met elkaar zijn in de aanwezigheid van een elektrolyt (zoals zout water) die een elektrisch geleidend pad tussen de twee creëert. Wanneer dit gebeurt, stromen metaalionen van het meer actieve metaal naar het minder actieve metaal, waardoor het meer actieve metaal in versnelde mate corrodeert en het minder-actieve metaal met een langzamere snelheid corrodeert. In de praktijk betekent dit dat er corrosie zal ontstaan op het meer actieve metaal op het contactpunt tussen de twee metalen.
2 Voorkom galvanische corrosie door de ionenstroom van het ene metaal naar het andere te stoppen. Een belangrijke vorm van corrosie die kan optreden ongeacht de fysieke sterkte van de betrokken metalen is galvanische corrosie. Galvanische corrosie treedt op wanneer twee metalen met verschillende elektrodenpotentialen in contact met elkaar zijn in de aanwezigheid van een elektrolyt (zoals zout water) die een elektrisch geleidend pad tussen de twee creëert. Wanneer dit gebeurt, stromen metaalionen van het meer actieve metaal naar het minder actieve metaal, waardoor het meer actieve metaal in versnelde mate corrodeert en het minder-actieve metaal met een langzamere snelheid corrodeert. In de praktijk betekent dit dat er corrosie zal ontstaan op het meer actieve metaal op het contactpunt tussen de twee metalen. - Elke methode van bescherming die ionenstroming tussen de metalen voorkomt, kan mogelijk galvanische corrosie stoppen. Door de metalen een beschermende coating te geven, kan worden voorkomen dat elektrolyten uit de omgeving een elektrisch geleidend pad tussen de twee metalen creëren, terwijl elektrochemische beschermingsprocessen zoals galvaniseren en anodiseren ook goed werken. Het is ook mogelijk om galvanische corrosie te verijdelen door de delen van de metalen die met elkaar in contact komen elektrisch te isoleren.
- Bovendien kan het gebruik van kathodische bescherming of een opofferende anode belangrijke metalen beschermen tegen galvanische corrosie. Zie hieronder voor meer informatie.
-
 3 Voorkom putcorrosie door het metalen oppervlak te beschermen, om bronnen van chloride uit de omgeving te vermijden en krassen en krassen te voorkomen. Pitting is een vorm van corrosie die plaatsvindt op microscopische schaal, maar die grote gevolgen kan hebben. Putvorming is van groot belang voor metalen die hun corrosiebestendigheid ontlenen aan een dunne laag passieve verbindingen op hun oppervlak, omdat deze vorm van corrosie kan leiden tot structurele storingen in situaties waar de beschermende laag ze normaal zou voorkomen. Pitting treedt op wanneer een klein deel van het metaal zijn beschermende passieve laag verliest. Wanneer dit gebeurt, vindt galvanische corrosie op microscopische schaal plaats, wat leidt tot de vorming van een klein gaatje in het metaal. In dit gat wordt de lokale omgeving zeer zuur, wat het proces versnelt. Pitting wordt meestal voorkomen door een beschermende coating op het metalen oppervlak aan te brengen en / of door kathodische bescherming te gebruiken.[9]
3 Voorkom putcorrosie door het metalen oppervlak te beschermen, om bronnen van chloride uit de omgeving te vermijden en krassen en krassen te voorkomen. Pitting is een vorm van corrosie die plaatsvindt op microscopische schaal, maar die grote gevolgen kan hebben. Putvorming is van groot belang voor metalen die hun corrosiebestendigheid ontlenen aan een dunne laag passieve verbindingen op hun oppervlak, omdat deze vorm van corrosie kan leiden tot structurele storingen in situaties waar de beschermende laag ze normaal zou voorkomen. Pitting treedt op wanneer een klein deel van het metaal zijn beschermende passieve laag verliest. Wanneer dit gebeurt, vindt galvanische corrosie op microscopische schaal plaats, wat leidt tot de vorming van een klein gaatje in het metaal. In dit gat wordt de lokale omgeving zeer zuur, wat het proces versnelt. Pitting wordt meestal voorkomen door een beschermende coating op het metalen oppervlak aan te brengen en / of door kathodische bescherming te gebruiken.[9] - Het is bekend dat blootstelling aan een omgeving met veel chloriden (zoals bijvoorbeeld zout water) het putproces versnelt.
-
 4 Voorkom spleetcorrosie door het minimaliseren van krappe ruimtes in het ontwerp van het object. Spleetcorrosie treedt op in ruimten van een metalen voorwerp waar de toegang tot de omringende vloeistof (lucht of een vloeistof) slecht is - bijvoorbeeld, onder schroeven, onder wasmachines, onder zeepokken, of tussen de scharnieren van een scharnier. Spleetcorrosie treedt op wanneer de opening nabij een metalen oppervlak breed genoeg is om vloeistof toe te laten, maar smal genoeg om de vloeistof moeilijk te verlaten en stagneert. De lokale omgeving in deze kleine ruimtes wordt corrosief en het metaal begint te corroderen in een proces dat lijkt op putcorrosie. Het voorkomen van spleetcorrosie is over het algemeen een ontwerpprobleem. Door het minimaliseren van het optreden van nauwe openingen in de constructie van een metalen object door deze openingen te dichten of circulatie mogelijk te maken, is het mogelijk de spleetcorrosie te minimaliseren.
4 Voorkom spleetcorrosie door het minimaliseren van krappe ruimtes in het ontwerp van het object. Spleetcorrosie treedt op in ruimten van een metalen voorwerp waar de toegang tot de omringende vloeistof (lucht of een vloeistof) slecht is - bijvoorbeeld, onder schroeven, onder wasmachines, onder zeepokken, of tussen de scharnieren van een scharnier. Spleetcorrosie treedt op wanneer de opening nabij een metalen oppervlak breed genoeg is om vloeistof toe te laten, maar smal genoeg om de vloeistof moeilijk te verlaten en stagneert. De lokale omgeving in deze kleine ruimtes wordt corrosief en het metaal begint te corroderen in een proces dat lijkt op putcorrosie. Het voorkomen van spleetcorrosie is over het algemeen een ontwerpprobleem. Door het minimaliseren van het optreden van nauwe openingen in de constructie van een metalen object door deze openingen te dichten of circulatie mogelijk te maken, is het mogelijk de spleetcorrosie te minimaliseren. - Spleetcorrosie is van bijzondere zorg wanneer het gaat om metalen zoals aluminium die een beschermende, passieve buitenlaag hebben, omdat het mechanisme van spleetcorrosie kan bijdragen aan de afbraak van deze laag.[10]
-
 5 Voorkom spanningscorrosie door alleen veilige ladingen en / of gloeien te gebruiken. Spanningscorrosie (SCC) is een zeldzame vorm van corrosiegerelateerd structureel falen dat vooral van belang is voor ingenieurs die belast zijn met bouwconstructies die bedoeld zijn om belangrijke ladingen te ondersteunen. In het geval van SCC vormt een dragend metaal scheuren en breuken onder de gespecificeerde belastingslimiet - in ernstige gevallen, bij een fractie van de limiet. In aanwezigheid van corrosieve ionen verspreiden zich kleine, microscopisch kleine scheurtjes in het metaal, veroorzaakt door trekspanning door een zware last, terwijl de corrosieve ionen de punt van de spleet bereiken. Dit zorgt ervoor dat de scheur geleidelijk groeit en mogelijk een structurele storing veroorzaakt. SCC is vooral gevaarlijk omdat het zelfs kan voorkomen in de aanwezigheid van stoffen die van nature slechts zeer licht corrosief zijn voor het metaal. Dit betekent dat de gevaarlijke corrosie optreedt terwijl de rest van het metalen oppervlak oppervlakkig onaangetast lijkt.[11]
5 Voorkom spanningscorrosie door alleen veilige ladingen en / of gloeien te gebruiken. Spanningscorrosie (SCC) is een zeldzame vorm van corrosiegerelateerd structureel falen dat vooral van belang is voor ingenieurs die belast zijn met bouwconstructies die bedoeld zijn om belangrijke ladingen te ondersteunen. In het geval van SCC vormt een dragend metaal scheuren en breuken onder de gespecificeerde belastingslimiet - in ernstige gevallen, bij een fractie van de limiet. In aanwezigheid van corrosieve ionen verspreiden zich kleine, microscopisch kleine scheurtjes in het metaal, veroorzaakt door trekspanning door een zware last, terwijl de corrosieve ionen de punt van de spleet bereiken. Dit zorgt ervoor dat de scheur geleidelijk groeit en mogelijk een structurele storing veroorzaakt. SCC is vooral gevaarlijk omdat het zelfs kan voorkomen in de aanwezigheid van stoffen die van nature slechts zeer licht corrosief zijn voor het metaal. Dit betekent dat de gevaarlijke corrosie optreedt terwijl de rest van het metalen oppervlak oppervlakkig onaangetast lijkt.[11] - Het voorkomen van SCC is deels een ontwerpprobleem. Door bijvoorbeeld een materiaal te kiezen dat bestand is tegen SCC in de omgeving waarin het metaal zal werken en ervoor te zorgen dat het metalen materiaal op de juiste manier wordt getest, kan het SCC helpen voorkomen. Bovendien kan het proces van het uitgloeien van een metaal resterende spanningen bij de vervaardiging ervan elimineren.
- Van SCC is bekend dat het wordt verergerd door hoge temperaturen en de aanwezigheid van vloeistof die opgeloste chloriden bevat.[12]
Methode twee van drie:
Corrosie voorkomen met Home Solutions
-
 1 Schilder het metalen oppervlak. Misschien is de meest gebruikelijke, betaalbare methode om metaal te beschermen tegen corrosie eenvoudigweg om het af te dekken met een laag verf. Het proces van corrosie omvat vocht en een oxidatiemiddel dat in wisselwerking staat met het oppervlak van het metaal. Wanneer dus het metaal wordt bekleed met een beschermende barrière van verf, kunnen noch vocht noch oxidatiemiddelen in contact komen met het metaal zelf en treedt er geen corrosie op.
1 Schilder het metalen oppervlak. Misschien is de meest gebruikelijke, betaalbare methode om metaal te beschermen tegen corrosie eenvoudigweg om het af te dekken met een laag verf. Het proces van corrosie omvat vocht en een oxidatiemiddel dat in wisselwerking staat met het oppervlak van het metaal. Wanneer dus het metaal wordt bekleed met een beschermende barrière van verf, kunnen noch vocht noch oxidatiemiddelen in contact komen met het metaal zelf en treedt er geen corrosie op. - De verf zelf is echter kwetsbaar voor degradatie. Breng verf opnieuw aan wanneer deze gechipt, versleten of beschadigd is. Als de verf zo verafschiet dat het onderliggende metaal zichtbaar wordt, moet u controleren of er corrosie of schade aan het blootgestelde metaal is.
- Er zijn verschillende methoden voor het aanbrengen van verf op metalen oppervlakken. Metaalarbeiders gebruiken vaak verschillende van deze methoden in combinatie om ervoor te zorgen dat het volledige metalen voorwerp een grondige coating krijgt. Hieronder vindt u een steekproef van methoden met opmerkingen over hun gebruik:
- Borstel - gebruikt voor moeilijk bereikbare plaatsen.
- Roller - gebruikt voor het afdekken van grote oppervlakken. Goedkoop en gemakkelijk.
- Luchtspray - wordt gebruikt voor het afdekken van grote oppervlakken. Sneller maar minder efficiënt dan rollen (verfverspilling is hoog).
- Airless-spray / elektrostatische airless-spray - wordt gebruikt voor het afdekken van grote oppervlakken. Snel en maakt variabele niveaus van dikke / dunne consistentie mogelijk. Minder verkwistend dan gewone luchtspray. Apparatuur is duur.
-
 2 Gebruik zeeverf voor metaal dat is blootgesteld aan water. Metalen objecten die regelmatig (of constant) in contact komen met het water, zoals boten, hebben speciale verf nodig om te beschermen tegen de verhoogde kans op corrosie. In deze situaties is "normale" corrosie in de vorm van roesten niet de enige zorg (hoewel het een belangrijke is), omdat het leven in zee (zeepokken, enz.) Dat kan groeien op onbeschermd metaal een extra bron van slijtage kan worden. en corrosie. Gebruik voor het beschermen van metalen objecten zoals boten enzovoort een hoogwaardige marine-epoxyverf. Niet alleen beschermen deze soorten verf het onderliggende metaal tegen vocht, maar ontmoedigen ook de groei van het onderwaterleven op het oppervlak.
2 Gebruik zeeverf voor metaal dat is blootgesteld aan water. Metalen objecten die regelmatig (of constant) in contact komen met het water, zoals boten, hebben speciale verf nodig om te beschermen tegen de verhoogde kans op corrosie. In deze situaties is "normale" corrosie in de vorm van roesten niet de enige zorg (hoewel het een belangrijke is), omdat het leven in zee (zeepokken, enz.) Dat kan groeien op onbeschermd metaal een extra bron van slijtage kan worden. en corrosie. Gebruik voor het beschermen van metalen objecten zoals boten enzovoort een hoogwaardige marine-epoxyverf. Niet alleen beschermen deze soorten verf het onderliggende metaal tegen vocht, maar ontmoedigen ook de groei van het onderwaterleven op het oppervlak. -
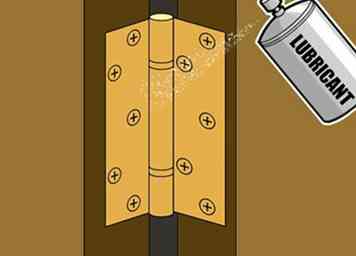 3 Breng beschermende smeermiddelen aan op bewegende metalen onderdelen. Voor platte, statische metalen oppervlakken houdt verf het uitstekend in het buiten houden van vocht en het voorkomen van corrosie zonder de bruikbaarheid van het metaal te beïnvloeden. Verven is echter meestal niet geschikt om metalen onderdelen te verplaatsen. Als u bijvoorbeeld over een deurscharnier schildert en de verf droogt, houdt het het scharnier op zijn plaats en belemmert het zijn beweging. Als je de deur open duwt, barst de verf, waardoor er gaten in het metaal achterblijven. Een betere keuze voor metalen onderdelen zoals scharnieren, verbindingen, lagers enzovoort is een geschikt, in water onoplosbaar smeermiddel. Een grondige laag van dit type smeermiddel zal natuurlijk vocht afstoten en tegelijkertijd zorgen voor een soepele, eenvoudige beweging van uw metalen onderdeel.
3 Breng beschermende smeermiddelen aan op bewegende metalen onderdelen. Voor platte, statische metalen oppervlakken houdt verf het uitstekend in het buiten houden van vocht en het voorkomen van corrosie zonder de bruikbaarheid van het metaal te beïnvloeden. Verven is echter meestal niet geschikt om metalen onderdelen te verplaatsen. Als u bijvoorbeeld over een deurscharnier schildert en de verf droogt, houdt het het scharnier op zijn plaats en belemmert het zijn beweging. Als je de deur open duwt, barst de verf, waardoor er gaten in het metaal achterblijven. Een betere keuze voor metalen onderdelen zoals scharnieren, verbindingen, lagers enzovoort is een geschikt, in water onoplosbaar smeermiddel. Een grondige laag van dit type smeermiddel zal natuurlijk vocht afstoten en tegelijkertijd zorgen voor een soepele, eenvoudige beweging van uw metalen onderdeel. - Omdat smeermiddelen niet op hun plaats drogen zoals verf, ze degraderen na verloop van tijd en vereisen af en toe opnieuw aanbrengen. Breng periodiek smeermiddelen op metalen delen aan om te zorgen dat ze effectief blijven als beschermende afdichtmiddelen.
-
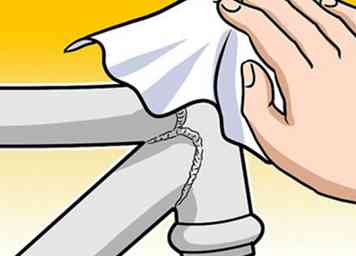 4 Reinig metalen oppervlakken grondig voordat u ze schildert of smeert. Of u nu normale verf, zeeverf of een beschermend smeermiddel / afdichtmiddel gebruikt, u moet ervoor zorgen dat uw metaal schoon en droog is voordat u het toepassingsproces start. Zorg ervoor dat het metaal volledig vrij is van vuil, vet, achtergebleven lasresten of bestaande corrosie, omdat deze dingen uw inspanningen kunnen ondermijnen door bij te dragen aan toekomstige corrosie.
4 Reinig metalen oppervlakken grondig voordat u ze schildert of smeert. Of u nu normale verf, zeeverf of een beschermend smeermiddel / afdichtmiddel gebruikt, u moet ervoor zorgen dat uw metaal schoon en droog is voordat u het toepassingsproces start. Zorg ervoor dat het metaal volledig vrij is van vuil, vet, achtergebleven lasresten of bestaande corrosie, omdat deze dingen uw inspanningen kunnen ondermijnen door bij te dragen aan toekomstige corrosie. - Vuil, vuil en ander vuil tast verf en smeermiddelen aan door te voorkomen dat de verf of het smeermiddel rechtstreeks op het metalen oppervlak blijft plakken. Als je bijvoorbeeld over een stuk staal met een paar losse metaalspaanders schildert, zal de verf op de spaanders gaan liggen, waardoor er lege plekken overblijven op het onderliggende metaal. Als en wanneer de krullen eraf vallen, is de blootgestelde plek kwetsbaar voor corrosie.
- Bij het verven of smeren van een metalen oppervlak met een beetje bestaande corrosie, zou het uw doel moeten zijn om het oppervlak zo glad en regelmatig mogelijk te maken om de best mogelijke hechting van het afdichtmiddel aan het metaal te verzekeren. Gebruik een staalborstel, schuurpapier en / of chemische roestverwijderaars om zoveel mogelijk losse corrosie te verwijderen.
-
 5 Houd onbeschermde metalen producten uit de buurt van vocht. Zoals hierboven opgemerkt, worden de meeste vormen van corrosie verergerd door vocht. Als het u niet lukt om uw metaal een beschermende laag verf of kit te geven, moet u ervoor zorgen dat het niet wordt blootgesteld aan vocht. Inspanningen om onbeschermde metalen gereedschappen droog te houden, kunnen hun bruikbaarheid verbeteren en de effectieve levensduur verlengen. Als uw metalen voorwerpen worden blootgesteld aan water of vocht, moet u deze onmiddellijk na gebruik reinigen en drogen om te voorkomen dat er corrosie ontstaat.
5 Houd onbeschermde metalen producten uit de buurt van vocht. Zoals hierboven opgemerkt, worden de meeste vormen van corrosie verergerd door vocht. Als het u niet lukt om uw metaal een beschermende laag verf of kit te geven, moet u ervoor zorgen dat het niet wordt blootgesteld aan vocht. Inspanningen om onbeschermde metalen gereedschappen droog te houden, kunnen hun bruikbaarheid verbeteren en de effectieve levensduur verlengen. Als uw metalen voorwerpen worden blootgesteld aan water of vocht, moet u deze onmiddellijk na gebruik reinigen en drogen om te voorkomen dat er corrosie ontstaat. - Naast het kijken naar blootstelling aan vocht tijdens gebruik, bewaar de metalen voorwerpen binnenshuis op een schone, droge plaats. Voor grote voorwerpen die niet in een kast of kast passen, bedek het object met een zeildoek of doek. Dit helpt vocht buiten de lucht houden en voorkomt dat zich stof ophoopt op het oppervlak.
-
 6 Houd metalen oppervlakken zo schoon mogelijk. Na elk gebruik van een metalen voorwerp, ongeacht of het metaal is geverfd of niet, moet u de functionele oppervlakken ervan schoonmaken en vuil, roet of stof verwijderen. Ophoping van vuil en puin op het metalen oppervlak kan bijdragen aan de slijtage en het oor van het metaal en / of de beschermende coating, wat in de loop van de tijd tot corrosie leidt.
6 Houd metalen oppervlakken zo schoon mogelijk. Na elk gebruik van een metalen voorwerp, ongeacht of het metaal is geverfd of niet, moet u de functionele oppervlakken ervan schoonmaken en vuil, roet of stof verwijderen. Ophoping van vuil en puin op het metalen oppervlak kan bijdragen aan de slijtage en het oor van het metaal en / of de beschermende coating, wat in de loop van de tijd tot corrosie leidt.
Methode drie van drie:
Corrosie voorkomen met geavanceerde elektrochemische oplossingen
-
 1 Gebruik een galvanisatieproces. Verzinkt metaal is metaal dat is bedekt met een dunne laag zink om het te beschermen tegen corrosie. Zink is chemisch actiever dan het onderliggende metaal[13], dus oxideert het bij blootstelling aan lucht. Zodra de zinklaag oxideert, vormt het een beschermende coating, waardoor verdere corrosie van het onderliggende metaal wordt voorkomen. Het meest gebruikelijke type verzinking van vandaag is een proces genaamd thermisch verzinken waarbij metalen onderdelen (meestal staal) worden ondergedompeld in een vat heet, gesmolten zink om een uniforme coating te verkrijgen.
1 Gebruik een galvanisatieproces. Verzinkt metaal is metaal dat is bedekt met een dunne laag zink om het te beschermen tegen corrosie. Zink is chemisch actiever dan het onderliggende metaal[13], dus oxideert het bij blootstelling aan lucht. Zodra de zinklaag oxideert, vormt het een beschermende coating, waardoor verdere corrosie van het onderliggende metaal wordt voorkomen. Het meest gebruikelijke type verzinking van vandaag is een proces genaamd thermisch verzinken waarbij metalen onderdelen (meestal staal) worden ondergedompeld in een vat heet, gesmolten zink om een uniforme coating te verkrijgen. - Dit proces omvat het hanteren van industriële chemicaliën, waarvan sommige gevaarlijk zijn bij kamertemperatuur, bij extreem hoge temperaturen en mogen daarom niet worden geprobeerd door iemand anders dan getrainde professionals. Hieronder staan de basisstappen van het thermisch verzinkproces voor staal:
- Het staal wordt gereinigd met een loogoplossing om vuil, vet, verf, enz. Te verwijderen en wordt vervolgens grondig gespoeld.
- Het staal wordt gebeitst in zuur om de walshuid te verwijderen en vervolgens gespoeld.
- Een materiaal genaamd a vloeien wordt aangebracht op het staal en laat drogen. Dit helpt de laatste zinklaag aan het staal hechten.
- Het staal wordt ondergedompeld in een vat gesmolten zink en toegestaan te verhitten tot de temperatuur van het zink.
- Het staal wordt afgekoeld in een "koeltank" die water bevat.
- Dit proces omvat het hanteren van industriële chemicaliën, waarvan sommige gevaarlijk zijn bij kamertemperatuur, bij extreem hoge temperaturen en mogen daarom niet worden geprobeerd door iemand anders dan getrainde professionals. Hieronder staan de basisstappen van het thermisch verzinkproces voor staal:
-
 2 Gebruik een opofferingsanode. Een manier om een metalen voorwerp te beschermen tegen corrosie is om een klein, reactief stuk metaal, genaamd a, elektrisch te verbinden opofferingsanode ernaar toe. Vanwege de elektrochemische relatie tussen het grotere metalen voorwerp en het kleine reactieve object (hieronder kort toegelicht), zal alleen het kleine, reactieve stuk metaal corrosie ondergaan, waardoor het grote, belangrijke metalen voorwerp intact blijft. Wanneer de opofferingsanode volledig corrodeert, moet deze worden vervangen of zal het grotere metalen voorwerp gaan corroderen. Deze methode van corrosiebescherming wordt vaak gebruikt voor begraven constructies, zoals ondergrondse opslagtanks, of objecten die constant in contact staan met water, zoals boten.
2 Gebruik een opofferingsanode. Een manier om een metalen voorwerp te beschermen tegen corrosie is om een klein, reactief stuk metaal, genaamd a, elektrisch te verbinden opofferingsanode ernaar toe. Vanwege de elektrochemische relatie tussen het grotere metalen voorwerp en het kleine reactieve object (hieronder kort toegelicht), zal alleen het kleine, reactieve stuk metaal corrosie ondergaan, waardoor het grote, belangrijke metalen voorwerp intact blijft. Wanneer de opofferingsanode volledig corrodeert, moet deze worden vervangen of zal het grotere metalen voorwerp gaan corroderen. Deze methode van corrosiebescherming wordt vaak gebruikt voor begraven constructies, zoals ondergrondse opslagtanks, of objecten die constant in contact staan met water, zoals boten. - Opofferingsanodes zijn gemaakt van verschillende soorten reactief metaal. Zink, aluminium en magnesium zijn drie van de meest voorkomende metalen die voor dit doel worden gebruikt. Vanwege de chemische eigenschappen van deze materialen worden zink en aluminium vaak gebruikt voor metalen voorwerpen in zout water, terwijl magnesium meer geschikt is voor zoetwaterdoeleinden.
- De reden dat een opofferingsanode werkt, heeft te maken met de chemie van het corrosieproces zelf. Wanneer een metalen object corrodeert, vormen zich op natuurlijke wijze gebieden aan die chemisch lijken op de anodes en kathoden in een elektrochemische cel. Elektronen stromen van de meeste anodendelen van het metaaloppervlak naar omliggende elektrolyten. Omdat opofferingsanodes zeer reactief zijn in vergelijking met het metaal van het te beschermen object, wordt het object zelf in vergelijking erg kathodisch en dus stromen elektronen uit de opofferende anode, waardoor deze corrodeert maar de rest van het metaal spaart.
-
 3 Gebruik geïmpacteerde stroom. Omdat het chemische proces achter corrosie van metaal elektrische stroom omvat in de vorm van elektronen die uit het metaal stromen, is het mogelijk om een externe bron van elektrische stroom te gebruiken om de corrosieve stroom te overmeesteren en corrosie te voorkomen. In wezen is dit proces (genoemd onder de indruk van de huidige) zorgt voor een continue negatieve elektrische lading op het metaal dat wordt beschermd.Deze lading overmeestert de stroom waardoor elektronen uit het metaal stromen, waardoor corrosie wordt gestopt. Dit type bescherming wordt vaak gebruikt voor begraven metalen constructies zoals opslagtanks en pijpleidingen.
3 Gebruik geïmpacteerde stroom. Omdat het chemische proces achter corrosie van metaal elektrische stroom omvat in de vorm van elektronen die uit het metaal stromen, is het mogelijk om een externe bron van elektrische stroom te gebruiken om de corrosieve stroom te overmeesteren en corrosie te voorkomen. In wezen is dit proces (genoemd onder de indruk van de huidige) zorgt voor een continue negatieve elektrische lading op het metaal dat wordt beschermd.Deze lading overmeestert de stroom waardoor elektronen uit het metaal stromen, waardoor corrosie wordt gestopt. Dit type bescherming wordt vaak gebruikt voor begraven metalen constructies zoals opslagtanks en pijpleidingen. - Merk op dat het type stroom dat wordt gebruikt voor onder druk staande huidige beveiligingssystemen gewoonlijk gelijkstroom (DC) is.
- Doorgaans wordt er corrosiewerende, geïmponeerde stroom gegenereerd door twee metalen anodes in de grond te begraven in de buurt van het te beschermen metalen object. Stroom wordt door een geïsoleerde draad naar de anodes gestuurd, die vervolgens door de grond en in het metalen voorwerp stroomt. Stroom gaat door het metalen voorwerp en keert terug naar de bron van de stroom (generator, gelijkrichter, etc.) via een geïsoleerde draad. [14]
-
 4 Gebruik anodisatie. Anodiseren is een speciaal type beschermende oppervlaktecoating die wordt gebruikt om metaal te beschermen tegen corrosie en ook om aan te brengen voor het aanbrengen van stempels, enzovoort. Als je ooit een felgekleurde metalen karabijnhaak hebt gezien, heb je een geverfd geanodiseerd metalen oppervlak gezien. In plaats van de fysieke toepassing van een beschermende coating, zoals bij het verven, gebruikt anodisatie een elektrische stroom om het metaal een beschermende coating te geven die bijna alle vormen van corrosie voorkomt.
4 Gebruik anodisatie. Anodiseren is een speciaal type beschermende oppervlaktecoating die wordt gebruikt om metaal te beschermen tegen corrosie en ook om aan te brengen voor het aanbrengen van stempels, enzovoort. Als je ooit een felgekleurde metalen karabijnhaak hebt gezien, heb je een geverfd geanodiseerd metalen oppervlak gezien. In plaats van de fysieke toepassing van een beschermende coating, zoals bij het verven, gebruikt anodisatie een elektrische stroom om het metaal een beschermende coating te geven die bijna alle vormen van corrosie voorkomt. - Het chemische proces achter anodisatie houdt het feit in dat veel metalen, zoals aluminium, van nature chemische producten vormen die oxides worden genoemd wanneer ze in contact komen met zuurstof in de lucht. Dit heeft tot gevolg dat het metaal normaliter een dunne buitenste oxidelaag heeft die (in variërende mate, afhankelijk van het metaal) beschermt tegen verdere corrosie. De elektrische stroom gebruikt in het anodisatieproces zorgt in essentie voor een veel dikkere opbouw van dit oxide op het oppervlak van het metaal dan normaal zou optreden, en biedt een grote bescherming tegen corrosie.
- Er zijn verschillende manieren om metalen te anodiseren. Hieronder volgen de basisstappen van één anodisatieproces.[15] Zie Anodiseer aluminium voor meer informatie.
- Het aluminium wordt gereinigd en ontvet.
- De oppervlakteverontreinigingen van het aluminium worden verwijderd met een de-smut oplossing.
- Het aluminium wordt verlaagd in een zuurbad bij een constante stroom en temperatuur (bijvoorbeeld 12 ampère / sq ft en 70-72 graden F (21-22 graden C).
- Het aluminium wordt verwijderd en gespoeld.
- Het aluminium is optioneel ondergedompeld in kleurstof bij 100-140 graden F (38-60 graden C).
- Het aluminium wordt verzegeld door het 20-30 minuten in kokend water te plaatsen.
-
 5 Gebruik een metaal dat passivering vertoont. Zoals hierboven opgemerkt, vormen sommige metalen van nature een beschermende oxidebekleding na blootstelling aan lucht. Sommige metalen vormen deze oxidebekleding zo effectief dat ze uiteindelijk relatief chemisch inactief worden. We zeggen dat deze metalen dat zijn passief in verwijzing naar het proces van passiveren waardoor ze minder reactief worden. Afhankelijk van het gewenste gebruik, hoeft een passief metalen voorwerp niet noodzakelijkerwijs nodig hebben elke extra bescherming om het corrosiebestendig te maken.
5 Gebruik een metaal dat passivering vertoont. Zoals hierboven opgemerkt, vormen sommige metalen van nature een beschermende oxidebekleding na blootstelling aan lucht. Sommige metalen vormen deze oxidebekleding zo effectief dat ze uiteindelijk relatief chemisch inactief worden. We zeggen dat deze metalen dat zijn passief in verwijzing naar het proces van passiveren waardoor ze minder reactief worden. Afhankelijk van het gewenste gebruik, hoeft een passief metalen voorwerp niet noodzakelijkerwijs nodig hebben elke extra bescherming om het corrosiebestendig te maken. - Een bekend voorbeeld van een metaal dat passivering vertoont, is roestvrij staal. Roestvrij staal is een legering van gewoon staal en chroom, die in de meeste omstandigheden effectief corrosiebestendig is zonder enige andere bescherming te vereisen. Voor de meeste dagelijkse toepassingen is corrosie meestal geen probleem voor roestvrij staal.
- Er wordt echter vermeld dat roestvrij staal onder bepaalde omstandigheden niet 100% corrosiebestendig is, met name in zout water. Evenzo worden veel passieve metalen onder bepaalde extreme omstandigheden niet-passief en zijn daarom mogelijk niet geschikt voor alle toepassingen.
- Een bekend voorbeeld van een metaal dat passivering vertoont, is roestvrij staal. Roestvrij staal is een legering van gewoon staal en chroom, die in de meeste omstandigheden effectief corrosiebestendig is zonder enige andere bescherming te vereisen. Voor de meeste dagelijkse toepassingen is corrosie meestal geen probleem voor roestvrij staal.
 Minotauromaquia
Minotauromaquia
 1 Voorkom uniforme aantastingscorrosie door het metaaloppervlak te beschermen. Uniforme aanvalscorrosie (soms verkort tot "uniforme" corrosie) is een type corrosie dat, op passende wijze, op uniforme wijze optreedt over een blootliggend metalen oppervlak. Bij dit type corrosie wordt het gehele oppervlak van het metaal door corrosie aangetast en dus gaat de corrosie met een uniforme snelheid voort. Als een onbeschermd ijzeren dak bijvoorbeeld regelmatig wordt blootgesteld aan regen, zal het hele dakoppervlak in contact komen met ongeveer dezelfde hoeveelheid water en zal het dus in dezelfde mate corroderen. De eenvoudigste manier om te beschermen tegen uniforme aanvalscorrosie is meestal om een beschermende barrière te plaatsen tussen het metaal en de corroderende stoffen.[7] Dit kan een breed scala aan dingen zijn - verf, een oliekit, of een elektrochemische oplossing zoals een gegalvaniseerde zinklaag.
1 Voorkom uniforme aantastingscorrosie door het metaaloppervlak te beschermen. Uniforme aanvalscorrosie (soms verkort tot "uniforme" corrosie) is een type corrosie dat, op passende wijze, op uniforme wijze optreedt over een blootliggend metalen oppervlak. Bij dit type corrosie wordt het gehele oppervlak van het metaal door corrosie aangetast en dus gaat de corrosie met een uniforme snelheid voort. Als een onbeschermd ijzeren dak bijvoorbeeld regelmatig wordt blootgesteld aan regen, zal het hele dakoppervlak in contact komen met ongeveer dezelfde hoeveelheid water en zal het dus in dezelfde mate corroderen. De eenvoudigste manier om te beschermen tegen uniforme aanvalscorrosie is meestal om een beschermende barrière te plaatsen tussen het metaal en de corroderende stoffen.[7] Dit kan een breed scala aan dingen zijn - verf, een oliekit, of een elektrochemische oplossing zoals een gegalvaniseerde zinklaag.  2 Voorkom galvanische corrosie door de ionenstroom van het ene metaal naar het andere te stoppen. Een belangrijke vorm van corrosie die kan optreden ongeacht de fysieke sterkte van de betrokken metalen is galvanische corrosie. Galvanische corrosie treedt op wanneer twee metalen met verschillende elektrodenpotentialen in contact met elkaar zijn in de aanwezigheid van een elektrolyt (zoals zout water) die een elektrisch geleidend pad tussen de twee creëert. Wanneer dit gebeurt, stromen metaalionen van het meer actieve metaal naar het minder actieve metaal, waardoor het meer actieve metaal in versnelde mate corrodeert en het minder-actieve metaal met een langzamere snelheid corrodeert. In de praktijk betekent dit dat er corrosie zal ontstaan op het meer actieve metaal op het contactpunt tussen de twee metalen.
2 Voorkom galvanische corrosie door de ionenstroom van het ene metaal naar het andere te stoppen. Een belangrijke vorm van corrosie die kan optreden ongeacht de fysieke sterkte van de betrokken metalen is galvanische corrosie. Galvanische corrosie treedt op wanneer twee metalen met verschillende elektrodenpotentialen in contact met elkaar zijn in de aanwezigheid van een elektrolyt (zoals zout water) die een elektrisch geleidend pad tussen de twee creëert. Wanneer dit gebeurt, stromen metaalionen van het meer actieve metaal naar het minder actieve metaal, waardoor het meer actieve metaal in versnelde mate corrodeert en het minder-actieve metaal met een langzamere snelheid corrodeert. In de praktijk betekent dit dat er corrosie zal ontstaan op het meer actieve metaal op het contactpunt tussen de twee metalen.  3 Voorkom putcorrosie door het metalen oppervlak te beschermen, om bronnen van chloride uit de omgeving te vermijden en krassen en krassen te voorkomen. Pitting is een vorm van corrosie die plaatsvindt op microscopische schaal, maar die grote gevolgen kan hebben. Putvorming is van groot belang voor metalen die hun corrosiebestendigheid ontlenen aan een dunne laag passieve verbindingen op hun oppervlak, omdat deze vorm van corrosie kan leiden tot structurele storingen in situaties waar de beschermende laag ze normaal zou voorkomen. Pitting treedt op wanneer een klein deel van het metaal zijn beschermende passieve laag verliest. Wanneer dit gebeurt, vindt galvanische corrosie op microscopische schaal plaats, wat leidt tot de vorming van een klein gaatje in het metaal. In dit gat wordt de lokale omgeving zeer zuur, wat het proces versnelt. Pitting wordt meestal voorkomen door een beschermende coating op het metalen oppervlak aan te brengen en / of door kathodische bescherming te gebruiken.[9]
3 Voorkom putcorrosie door het metalen oppervlak te beschermen, om bronnen van chloride uit de omgeving te vermijden en krassen en krassen te voorkomen. Pitting is een vorm van corrosie die plaatsvindt op microscopische schaal, maar die grote gevolgen kan hebben. Putvorming is van groot belang voor metalen die hun corrosiebestendigheid ontlenen aan een dunne laag passieve verbindingen op hun oppervlak, omdat deze vorm van corrosie kan leiden tot structurele storingen in situaties waar de beschermende laag ze normaal zou voorkomen. Pitting treedt op wanneer een klein deel van het metaal zijn beschermende passieve laag verliest. Wanneer dit gebeurt, vindt galvanische corrosie op microscopische schaal plaats, wat leidt tot de vorming van een klein gaatje in het metaal. In dit gat wordt de lokale omgeving zeer zuur, wat het proces versnelt. Pitting wordt meestal voorkomen door een beschermende coating op het metalen oppervlak aan te brengen en / of door kathodische bescherming te gebruiken.[9]  4 Voorkom spleetcorrosie door het minimaliseren van krappe ruimtes in het ontwerp van het object. Spleetcorrosie treedt op in ruimten van een metalen voorwerp waar de toegang tot de omringende vloeistof (lucht of een vloeistof) slecht is - bijvoorbeeld, onder schroeven, onder wasmachines, onder zeepokken, of tussen de scharnieren van een scharnier. Spleetcorrosie treedt op wanneer de opening nabij een metalen oppervlak breed genoeg is om vloeistof toe te laten, maar smal genoeg om de vloeistof moeilijk te verlaten en stagneert. De lokale omgeving in deze kleine ruimtes wordt corrosief en het metaal begint te corroderen in een proces dat lijkt op putcorrosie. Het voorkomen van spleetcorrosie is over het algemeen een ontwerpprobleem. Door het minimaliseren van het optreden van nauwe openingen in de constructie van een metalen object door deze openingen te dichten of circulatie mogelijk te maken, is het mogelijk de spleetcorrosie te minimaliseren.
4 Voorkom spleetcorrosie door het minimaliseren van krappe ruimtes in het ontwerp van het object. Spleetcorrosie treedt op in ruimten van een metalen voorwerp waar de toegang tot de omringende vloeistof (lucht of een vloeistof) slecht is - bijvoorbeeld, onder schroeven, onder wasmachines, onder zeepokken, of tussen de scharnieren van een scharnier. Spleetcorrosie treedt op wanneer de opening nabij een metalen oppervlak breed genoeg is om vloeistof toe te laten, maar smal genoeg om de vloeistof moeilijk te verlaten en stagneert. De lokale omgeving in deze kleine ruimtes wordt corrosief en het metaal begint te corroderen in een proces dat lijkt op putcorrosie. Het voorkomen van spleetcorrosie is over het algemeen een ontwerpprobleem. Door het minimaliseren van het optreden van nauwe openingen in de constructie van een metalen object door deze openingen te dichten of circulatie mogelijk te maken, is het mogelijk de spleetcorrosie te minimaliseren.  5 Voorkom spanningscorrosie door alleen veilige ladingen en / of gloeien te gebruiken. Spanningscorrosie (SCC) is een zeldzame vorm van corrosiegerelateerd structureel falen dat vooral van belang is voor ingenieurs die belast zijn met bouwconstructies die bedoeld zijn om belangrijke ladingen te ondersteunen. In het geval van SCC vormt een dragend metaal scheuren en breuken onder de gespecificeerde belastingslimiet - in ernstige gevallen, bij een fractie van de limiet. In aanwezigheid van corrosieve ionen verspreiden zich kleine, microscopisch kleine scheurtjes in het metaal, veroorzaakt door trekspanning door een zware last, terwijl de corrosieve ionen de punt van de spleet bereiken. Dit zorgt ervoor dat de scheur geleidelijk groeit en mogelijk een structurele storing veroorzaakt. SCC is vooral gevaarlijk omdat het zelfs kan voorkomen in de aanwezigheid van stoffen die van nature slechts zeer licht corrosief zijn voor het metaal. Dit betekent dat de gevaarlijke corrosie optreedt terwijl de rest van het metalen oppervlak oppervlakkig onaangetast lijkt.[11]
5 Voorkom spanningscorrosie door alleen veilige ladingen en / of gloeien te gebruiken. Spanningscorrosie (SCC) is een zeldzame vorm van corrosiegerelateerd structureel falen dat vooral van belang is voor ingenieurs die belast zijn met bouwconstructies die bedoeld zijn om belangrijke ladingen te ondersteunen. In het geval van SCC vormt een dragend metaal scheuren en breuken onder de gespecificeerde belastingslimiet - in ernstige gevallen, bij een fractie van de limiet. In aanwezigheid van corrosieve ionen verspreiden zich kleine, microscopisch kleine scheurtjes in het metaal, veroorzaakt door trekspanning door een zware last, terwijl de corrosieve ionen de punt van de spleet bereiken. Dit zorgt ervoor dat de scheur geleidelijk groeit en mogelijk een structurele storing veroorzaakt. SCC is vooral gevaarlijk omdat het zelfs kan voorkomen in de aanwezigheid van stoffen die van nature slechts zeer licht corrosief zijn voor het metaal. Dit betekent dat de gevaarlijke corrosie optreedt terwijl de rest van het metalen oppervlak oppervlakkig onaangetast lijkt.[11]  1 Schilder het metalen oppervlak. Misschien is de meest gebruikelijke, betaalbare methode om metaal te beschermen tegen corrosie eenvoudigweg om het af te dekken met een laag verf. Het proces van corrosie omvat vocht en een oxidatiemiddel dat in wisselwerking staat met het oppervlak van het metaal. Wanneer dus het metaal wordt bekleed met een beschermende barrière van verf, kunnen noch vocht noch oxidatiemiddelen in contact komen met het metaal zelf en treedt er geen corrosie op.
1 Schilder het metalen oppervlak. Misschien is de meest gebruikelijke, betaalbare methode om metaal te beschermen tegen corrosie eenvoudigweg om het af te dekken met een laag verf. Het proces van corrosie omvat vocht en een oxidatiemiddel dat in wisselwerking staat met het oppervlak van het metaal. Wanneer dus het metaal wordt bekleed met een beschermende barrière van verf, kunnen noch vocht noch oxidatiemiddelen in contact komen met het metaal zelf en treedt er geen corrosie op.  2 Gebruik zeeverf voor metaal dat is blootgesteld aan water. Metalen objecten die regelmatig (of constant) in contact komen met het water, zoals boten, hebben speciale verf nodig om te beschermen tegen de verhoogde kans op corrosie. In deze situaties is "normale" corrosie in de vorm van roesten niet de enige zorg (hoewel het een belangrijke is), omdat het leven in zee (zeepokken, enz.) Dat kan groeien op onbeschermd metaal een extra bron van slijtage kan worden. en corrosie. Gebruik voor het beschermen van metalen objecten zoals boten enzovoort een hoogwaardige marine-epoxyverf. Niet alleen beschermen deze soorten verf het onderliggende metaal tegen vocht, maar ontmoedigen ook de groei van het onderwaterleven op het oppervlak.
2 Gebruik zeeverf voor metaal dat is blootgesteld aan water. Metalen objecten die regelmatig (of constant) in contact komen met het water, zoals boten, hebben speciale verf nodig om te beschermen tegen de verhoogde kans op corrosie. In deze situaties is "normale" corrosie in de vorm van roesten niet de enige zorg (hoewel het een belangrijke is), omdat het leven in zee (zeepokken, enz.) Dat kan groeien op onbeschermd metaal een extra bron van slijtage kan worden. en corrosie. Gebruik voor het beschermen van metalen objecten zoals boten enzovoort een hoogwaardige marine-epoxyverf. Niet alleen beschermen deze soorten verf het onderliggende metaal tegen vocht, maar ontmoedigen ook de groei van het onderwaterleven op het oppervlak.  3 Breng beschermende smeermiddelen aan op bewegende metalen onderdelen. Voor platte, statische metalen oppervlakken houdt verf het uitstekend in het buiten houden van vocht en het voorkomen van corrosie zonder de bruikbaarheid van het metaal te beïnvloeden. Verven is echter meestal niet geschikt om metalen onderdelen te verplaatsen. Als u bijvoorbeeld over een deurscharnier schildert en de verf droogt, houdt het het scharnier op zijn plaats en belemmert het zijn beweging. Als je de deur open duwt, barst de verf, waardoor er gaten in het metaal achterblijven. Een betere keuze voor metalen onderdelen zoals scharnieren, verbindingen, lagers enzovoort is een geschikt, in water onoplosbaar smeermiddel. Een grondige laag van dit type smeermiddel zal natuurlijk vocht afstoten en tegelijkertijd zorgen voor een soepele, eenvoudige beweging van uw metalen onderdeel.
3 Breng beschermende smeermiddelen aan op bewegende metalen onderdelen. Voor platte, statische metalen oppervlakken houdt verf het uitstekend in het buiten houden van vocht en het voorkomen van corrosie zonder de bruikbaarheid van het metaal te beïnvloeden. Verven is echter meestal niet geschikt om metalen onderdelen te verplaatsen. Als u bijvoorbeeld over een deurscharnier schildert en de verf droogt, houdt het het scharnier op zijn plaats en belemmert het zijn beweging. Als je de deur open duwt, barst de verf, waardoor er gaten in het metaal achterblijven. Een betere keuze voor metalen onderdelen zoals scharnieren, verbindingen, lagers enzovoort is een geschikt, in water onoplosbaar smeermiddel. Een grondige laag van dit type smeermiddel zal natuurlijk vocht afstoten en tegelijkertijd zorgen voor een soepele, eenvoudige beweging van uw metalen onderdeel.  4 Reinig metalen oppervlakken grondig voordat u ze schildert of smeert. Of u nu normale verf, zeeverf of een beschermend smeermiddel / afdichtmiddel gebruikt, u moet ervoor zorgen dat uw metaal schoon en droog is voordat u het toepassingsproces start. Zorg ervoor dat het metaal volledig vrij is van vuil, vet, achtergebleven lasresten of bestaande corrosie, omdat deze dingen uw inspanningen kunnen ondermijnen door bij te dragen aan toekomstige corrosie.
4 Reinig metalen oppervlakken grondig voordat u ze schildert of smeert. Of u nu normale verf, zeeverf of een beschermend smeermiddel / afdichtmiddel gebruikt, u moet ervoor zorgen dat uw metaal schoon en droog is voordat u het toepassingsproces start. Zorg ervoor dat het metaal volledig vrij is van vuil, vet, achtergebleven lasresten of bestaande corrosie, omdat deze dingen uw inspanningen kunnen ondermijnen door bij te dragen aan toekomstige corrosie.  5 Houd onbeschermde metalen producten uit de buurt van vocht. Zoals hierboven opgemerkt, worden de meeste vormen van corrosie verergerd door vocht. Als het u niet lukt om uw metaal een beschermende laag verf of kit te geven, moet u ervoor zorgen dat het niet wordt blootgesteld aan vocht. Inspanningen om onbeschermde metalen gereedschappen droog te houden, kunnen hun bruikbaarheid verbeteren en de effectieve levensduur verlengen. Als uw metalen voorwerpen worden blootgesteld aan water of vocht, moet u deze onmiddellijk na gebruik reinigen en drogen om te voorkomen dat er corrosie ontstaat.
5 Houd onbeschermde metalen producten uit de buurt van vocht. Zoals hierboven opgemerkt, worden de meeste vormen van corrosie verergerd door vocht. Als het u niet lukt om uw metaal een beschermende laag verf of kit te geven, moet u ervoor zorgen dat het niet wordt blootgesteld aan vocht. Inspanningen om onbeschermde metalen gereedschappen droog te houden, kunnen hun bruikbaarheid verbeteren en de effectieve levensduur verlengen. Als uw metalen voorwerpen worden blootgesteld aan water of vocht, moet u deze onmiddellijk na gebruik reinigen en drogen om te voorkomen dat er corrosie ontstaat.  6 Houd metalen oppervlakken zo schoon mogelijk. Na elk gebruik van een metalen voorwerp, ongeacht of het metaal is geverfd of niet, moet u de functionele oppervlakken ervan schoonmaken en vuil, roet of stof verwijderen. Ophoping van vuil en puin op het metalen oppervlak kan bijdragen aan de slijtage en het oor van het metaal en / of de beschermende coating, wat in de loop van de tijd tot corrosie leidt.
6 Houd metalen oppervlakken zo schoon mogelijk. Na elk gebruik van een metalen voorwerp, ongeacht of het metaal is geverfd of niet, moet u de functionele oppervlakken ervan schoonmaken en vuil, roet of stof verwijderen. Ophoping van vuil en puin op het metalen oppervlak kan bijdragen aan de slijtage en het oor van het metaal en / of de beschermende coating, wat in de loop van de tijd tot corrosie leidt.  1 Gebruik een galvanisatieproces. Verzinkt metaal is metaal dat is bedekt met een dunne laag zink om het te beschermen tegen corrosie. Zink is chemisch actiever dan het onderliggende metaal[13], dus oxideert het bij blootstelling aan lucht. Zodra de zinklaag oxideert, vormt het een beschermende coating, waardoor verdere corrosie van het onderliggende metaal wordt voorkomen. Het meest gebruikelijke type verzinking van vandaag is een proces genaamd thermisch verzinken waarbij metalen onderdelen (meestal staal) worden ondergedompeld in een vat heet, gesmolten zink om een uniforme coating te verkrijgen.
1 Gebruik een galvanisatieproces. Verzinkt metaal is metaal dat is bedekt met een dunne laag zink om het te beschermen tegen corrosie. Zink is chemisch actiever dan het onderliggende metaal[13], dus oxideert het bij blootstelling aan lucht. Zodra de zinklaag oxideert, vormt het een beschermende coating, waardoor verdere corrosie van het onderliggende metaal wordt voorkomen. Het meest gebruikelijke type verzinking van vandaag is een proces genaamd thermisch verzinken waarbij metalen onderdelen (meestal staal) worden ondergedompeld in een vat heet, gesmolten zink om een uniforme coating te verkrijgen.  2 Gebruik een opofferingsanode. Een manier om een metalen voorwerp te beschermen tegen corrosie is om een klein, reactief stuk metaal, genaamd a, elektrisch te verbinden opofferingsanode ernaar toe. Vanwege de elektrochemische relatie tussen het grotere metalen voorwerp en het kleine reactieve object (hieronder kort toegelicht), zal alleen het kleine, reactieve stuk metaal corrosie ondergaan, waardoor het grote, belangrijke metalen voorwerp intact blijft. Wanneer de opofferingsanode volledig corrodeert, moet deze worden vervangen of zal het grotere metalen voorwerp gaan corroderen. Deze methode van corrosiebescherming wordt vaak gebruikt voor begraven constructies, zoals ondergrondse opslagtanks, of objecten die constant in contact staan met water, zoals boten.
2 Gebruik een opofferingsanode. Een manier om een metalen voorwerp te beschermen tegen corrosie is om een klein, reactief stuk metaal, genaamd a, elektrisch te verbinden opofferingsanode ernaar toe. Vanwege de elektrochemische relatie tussen het grotere metalen voorwerp en het kleine reactieve object (hieronder kort toegelicht), zal alleen het kleine, reactieve stuk metaal corrosie ondergaan, waardoor het grote, belangrijke metalen voorwerp intact blijft. Wanneer de opofferingsanode volledig corrodeert, moet deze worden vervangen of zal het grotere metalen voorwerp gaan corroderen. Deze methode van corrosiebescherming wordt vaak gebruikt voor begraven constructies, zoals ondergrondse opslagtanks, of objecten die constant in contact staan met water, zoals boten.  3 Gebruik geïmpacteerde stroom. Omdat het chemische proces achter corrosie van metaal elektrische stroom omvat in de vorm van elektronen die uit het metaal stromen, is het mogelijk om een externe bron van elektrische stroom te gebruiken om de corrosieve stroom te overmeesteren en corrosie te voorkomen. In wezen is dit proces (genoemd onder de indruk van de huidige) zorgt voor een continue negatieve elektrische lading op het metaal dat wordt beschermd.Deze lading overmeestert de stroom waardoor elektronen uit het metaal stromen, waardoor corrosie wordt gestopt. Dit type bescherming wordt vaak gebruikt voor begraven metalen constructies zoals opslagtanks en pijpleidingen.
3 Gebruik geïmpacteerde stroom. Omdat het chemische proces achter corrosie van metaal elektrische stroom omvat in de vorm van elektronen die uit het metaal stromen, is het mogelijk om een externe bron van elektrische stroom te gebruiken om de corrosieve stroom te overmeesteren en corrosie te voorkomen. In wezen is dit proces (genoemd onder de indruk van de huidige) zorgt voor een continue negatieve elektrische lading op het metaal dat wordt beschermd.Deze lading overmeestert de stroom waardoor elektronen uit het metaal stromen, waardoor corrosie wordt gestopt. Dit type bescherming wordt vaak gebruikt voor begraven metalen constructies zoals opslagtanks en pijpleidingen.  4 Gebruik anodisatie. Anodiseren is een speciaal type beschermende oppervlaktecoating die wordt gebruikt om metaal te beschermen tegen corrosie en ook om aan te brengen voor het aanbrengen van stempels, enzovoort. Als je ooit een felgekleurde metalen karabijnhaak hebt gezien, heb je een geverfd geanodiseerd metalen oppervlak gezien. In plaats van de fysieke toepassing van een beschermende coating, zoals bij het verven, gebruikt anodisatie een elektrische stroom om het metaal een beschermende coating te geven die bijna alle vormen van corrosie voorkomt.
4 Gebruik anodisatie. Anodiseren is een speciaal type beschermende oppervlaktecoating die wordt gebruikt om metaal te beschermen tegen corrosie en ook om aan te brengen voor het aanbrengen van stempels, enzovoort. Als je ooit een felgekleurde metalen karabijnhaak hebt gezien, heb je een geverfd geanodiseerd metalen oppervlak gezien. In plaats van de fysieke toepassing van een beschermende coating, zoals bij het verven, gebruikt anodisatie een elektrische stroom om het metaal een beschermende coating te geven die bijna alle vormen van corrosie voorkomt.  5 Gebruik een metaal dat passivering vertoont. Zoals hierboven opgemerkt, vormen sommige metalen van nature een beschermende oxidebekleding na blootstelling aan lucht. Sommige metalen vormen deze oxidebekleding zo effectief dat ze uiteindelijk relatief chemisch inactief worden. We zeggen dat deze metalen dat zijn passief in verwijzing naar het proces van passiveren waardoor ze minder reactief worden. Afhankelijk van het gewenste gebruik, hoeft een passief metalen voorwerp niet noodzakelijkerwijs nodig hebben elke extra bescherming om het corrosiebestendig te maken.
5 Gebruik een metaal dat passivering vertoont. Zoals hierboven opgemerkt, vormen sommige metalen van nature een beschermende oxidebekleding na blootstelling aan lucht. Sommige metalen vormen deze oxidebekleding zo effectief dat ze uiteindelijk relatief chemisch inactief worden. We zeggen dat deze metalen dat zijn passief in verwijzing naar het proces van passiveren waardoor ze minder reactief worden. Afhankelijk van het gewenste gebruik, hoeft een passief metalen voorwerp niet noodzakelijkerwijs nodig hebben elke extra bescherming om het corrosiebestendig te maken.