Het behalen van een algemene chemiecursus vereist een goed begrip van de grondbeginselen, het vermogen om wat basis wiskunde te doen, een rekenmachine te gebruiken voor geavanceerdere vergelijkingen en de bereidheid om kennis te nemen van een complex onderwerp. Chemie is de studie van materie en zijn eigenschappen. Alles om je heen heeft te maken met scheikunde. Zelfs eenvoudige dingen die u als vanzelfsprekend mag beschouwen, zoals het water dat u drinkt en de lucht die u inademt. Houd een open geest als je leert over wat er overal om je heen gebeurt, tot op atomair niveau. Je eerste blootstelling aan chemie kan een uitdaging zijn en opwindend.
Deel een van de acht:
Inzicht in atomaire structuren
-
 1 Begin met de meest elementaire structuren. Om je scheikunde klas te halen, moet je een goed begrip hebben van de bouwstenen die alles vormen wat substantie of massa heeft.
1 Begin met de meest elementaire structuren. Om je scheikunde klas te halen, moet je een goed begrip hebben van de bouwstenen die alles vormen wat substantie of massa heeft. - Het atoom is waar de chemie begint. Alles in de klas zal een extensie zijn, gebaseerd op die basisinformatie. Zorg ervoor dat je de tijd neemt om het materiaal op atomen te begrijpen.
-
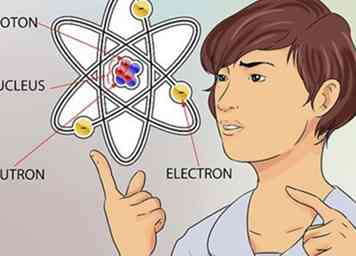 2 Grijp het concept van een atoom. Een atoom wordt beschouwd als de kleinste bouwsteen van alles dat massa heeft, inclusief dingen die we niet altijd kunnen zien, zoals gassen. Maar zelfs het kleine atoom heeft nog kleinere delen waaruit zijn structuur bestaat.[1]
2 Grijp het concept van een atoom. Een atoom wordt beschouwd als de kleinste bouwsteen van alles dat massa heeft, inclusief dingen die we niet altijd kunnen zien, zoals gassen. Maar zelfs het kleine atoom heeft nog kleinere delen waaruit zijn structuur bestaat.[1] - Een atoom bestaat uit 3 delen. Die delen zijn neutronen, protonen en elektronen. Het centrum van het atoom wordt de kern genoemd. De kern bestaat uit neutronen en protonen. Elektronen zijn de deeltjes die rond het buitenste deel van het atoom drijven, zoals planeten die om de zon cirkelen.[2]
- De grootte van een atoom is ongelooflijk klein. Om een beetje perspectief te geven, denk eens aan de grootste sportarena die je kent, misschien de Houston Astrodome. Als je de Astrodome als het atoom beschouwt, dan is de kern van dat atoom ongeveer zo groot als een erwt ergens rond de 50 yard-lijn.[3]
-
 3 Het atomaire raamwerk van een element begrijpen. Een element wordt beschouwd als een stof in de natuur die niet kan worden opgesplitst in andere elementen, of in een eenvoudiger vorm. Elementen zijn gemaakt van atomen.[4]
3 Het atomaire raamwerk van een element begrijpen. Een element wordt beschouwd als een stof in de natuur die niet kan worden opgesplitst in andere elementen, of in een eenvoudiger vorm. Elementen zijn gemaakt van atomen.[4] - De atomen van een specifiek element zijn altijd hetzelfde. Dit betekent dat elk element een bekend en uniek aantal neutronen en protonen in zijn atomaire structuur heeft.[5]
-
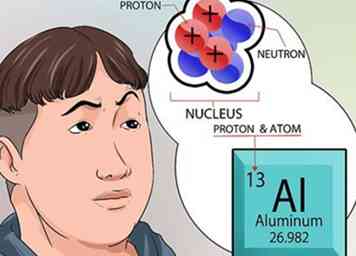 4 Begrijp meer over de kern. De neutronen, gevonden in de kern, zijn neutraal belast. Protonen hebben een positieve lading. Het atoomnummer van een element is exact hetzelfde als het aantal protonen in de kern.[6]
4 Begrijp meer over de kern. De neutronen, gevonden in de kern, zijn neutraal belast. Protonen hebben een positieve lading. Het atoomnummer van een element is exact hetzelfde als het aantal protonen in de kern.[6] - U hoeft niets te berekenen om het aantal protonen in de kern van een element te kennen. Dat nummer wordt bovenaan elk vakje afgedrukt, voor elk element, in het periodiek systeem.
-
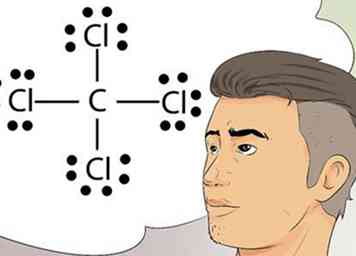 5 Herken Lewis-diagrammen. Lewis-diagrammen worden soms elektronenpuntdiagrammen genoemd. Dit zijn eenvoudige diagrammen die stippen gebruiken om de gepaarde en ongepaarde elektronen in de buitenste schil van een atoom weer te geven.[7]
5 Herken Lewis-diagrammen. Lewis-diagrammen worden soms elektronenpuntdiagrammen genoemd. Dit zijn eenvoudige diagrammen die stippen gebruiken om de gepaarde en ongepaarde elektronen in de buitenste schil van een atoom weer te geven.[7] - Lewis-structuren zijn nuttig bij het tekenen van eenvoudige diagrammen die bindingen identificeren, zoals covalente bindingen, die worden gedeeld tussen elementen in een atoom of molecuul.[8]
-
 6 Weet wat de octetregel betekent. Lewis-diagrammen werken op de octet-regel, die stelt dat atomen stabiel zijn wanneer ze toegang hebben tot acht elektronen in de buitenste schil. Waterstof is de uitzondering en wordt als stabiel beschouwd met twee elektronen in de buitenste schil.[9]
6 Weet wat de octetregel betekent. Lewis-diagrammen werken op de octet-regel, die stelt dat atomen stabiel zijn wanneer ze toegang hebben tot acht elektronen in de buitenste schil. Waterstof is de uitzondering en wordt als stabiel beschouwd met twee elektronen in de buitenste schil.[9] -
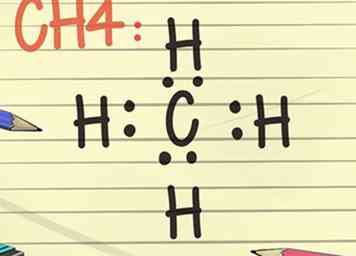 7 Teken een Lewis-diagram. Het symbool voor een element, omgeven door een rangschikking van punten, is een Lewis-diagram. Beschouw het diagram als een stilstaand beeld van een film. In plaats van dat de elektronen rond de buitenkant van het element ronddraaien, worden ze weergegeven als een vast moment in de tijd.[10]
7 Teken een Lewis-diagram. Het symbool voor een element, omgeven door een rangschikking van punten, is een Lewis-diagram. Beschouw het diagram als een stilstaand beeld van een film. In plaats van dat de elektronen rond de buitenkant van het element ronddraaien, worden ze weergegeven als een vast moment in de tijd.[10] - Het diagram toont de stabiele opstelling van elektronen, waar ze zich binden aan het volgende element, en informatie over de sterkte van de bindingen, bijvoorbeeld of de bindingen worden gedeeld of verdubbeld.
- Denk aan de octet-regel en stel het symbool voor een element voor, misschien C voor koolstof. Plaats of maak nu 2 stippen op elke kompaspositie, dit betekent 2 stippen ten noorden van de C, oost, west en zuid. Stel je nu een H voor, die een waterstofatoom weergeeft aan de andere kant van elk van de 2 stippen. Dit voltooide Lewis-diagram betekent dat het enkele koolstofatoom in het centrum is omgeven door 4 waterstofatomen. De elektronen zijn op een covalente manier gebonden, wat betekent dat de koolstof- en waterstofatomen één van hun elektronen delen om zich aan elkaar te binden.[11]
- De molecuulformule voor dit voorbeeld is CH4 en is de formule voor methaangas.
-
 8 Begrijp de rangschikking van elektronen terwijl ze elementen aan elkaar binden. De Lewis-diagrammen zijn een simplistische visuele weergave van wat er wordt begrepen over chemische bindingen.
8 Begrijp de rangschikking van elektronen terwijl ze elementen aan elkaar binden. De Lewis-diagrammen zijn een simplistische visuele weergave van wat er wordt begrepen over chemische bindingen. - Praat met je professor, of met leden van je studiegroep als de concepten over chemische binding en Lewis-diagrammen niet duidelijk zijn.
Tweede deel van Eight:
Het periodiek systeem lezen en begrijpen
-
 1 Kijk naar het periodiek systeem. Als u problemen ondervindt met de eigenschappen van elementen, besteed dan enige tijd aan het doornemen van elk beschikbaar materiaal in het periodiek systeem. Het belangrijkste is om er goed naar te kijken.
1 Kijk naar het periodiek systeem. Als u problemen ondervindt met de eigenschappen van elementen, besteed dan enige tijd aan het doornemen van elk beschikbaar materiaal in het periodiek systeem. Het belangrijkste is om er goed naar te kijken. - Het periodiek systeem begrijpen is van cruciaal belang voor het behalen van het eerste deel van uw scheikundeles.
- 2 Identificeer de elementen op het periodiek systeem. Het periodiek systeem bestaat alleen uit elementen. Elk element heeft een symbool dat bestaat uit een of twee letters. Dat symbool identificeert altijd dat element. Na, bijvoorbeeld, betekent altijd natrium. De volledige naam van het element verschijnt net onder het symbool.[12]
- 3 Zoek het atoomnummer van elk element. Het getal boven het symbool is het atoomnummer. Het atoomnummer is hetzelfde als het aantal protonen dat in de kern wordt gevonden.[13]
-
 4 Zoek de atomaire massa van elk element. Het getal onderaan is de atoommassa. Onthoud dat het aantal protonen in combinatie met het aantal neutronen in de kern gelijk is aan het atomaire massagetal.[14]
4 Zoek de atomaire massa van elk element. Het getal onderaan is de atoommassa. Onthoud dat het aantal protonen in combinatie met het aantal neutronen in de kern gelijk is aan het atomaire massagetal.[14] -
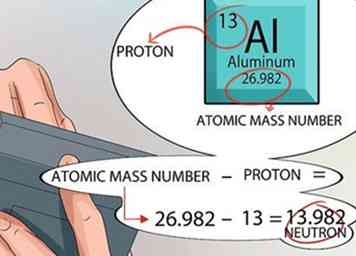 5 Bereken het aantal neutronen gevonden in de kern. U kunt de cijfers op het periodiek systeem gebruiken om dit uit te zoeken. Het atoomnummer voor elk element is exact hetzelfde als het aantal protonen dat in de kern wordt gevonden.
5 Bereken het aantal neutronen gevonden in de kern. U kunt de cijfers op het periodiek systeem gebruiken om dit uit te zoeken. Het atoomnummer voor elk element is exact hetzelfde als het aantal protonen dat in de kern wordt gevonden. - De atomaire massa-eenheid wordt afgedrukt voor elk element in het vierkant onderaan, net onder de naam van het element.
- Onthoud dat de enige twee dingen die zich in de kern van een atoom bevinden, protonen en neutronen zijn. Het periodiek systeem vertelt u het aantal protonen en vertelt u het atoommassanummer.
- Vanaf dat punt is de wiskunde eenvoudig. Trek het aantal protonen af van het atomaire massagetal en dat geeft je het aantal neutronen in de kern van elk atoom voor dat element.[15]
-
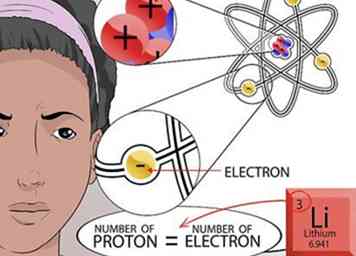 6 Bereken het aantal elektronen. Onthoud dat tegenpolen elkaar aantrekken. Elektronen zijn positief geladen deeltjes die rond de kern van atoomachtige planeten rond de zon vliegen. Het aantal negatief geladen elektronen dat naar de kern wordt getrokken, hangt af van het aantal positief geladen protonen in de kern.
6 Bereken het aantal elektronen. Onthoud dat tegenpolen elkaar aantrekken. Elektronen zijn positief geladen deeltjes die rond de kern van atoomachtige planeten rond de zon vliegen. Het aantal negatief geladen elektronen dat naar de kern wordt getrokken, hangt af van het aantal positief geladen protonen in de kern. - Omdat een atoom geen totale lading heeft, moeten alle positieve en negatieve ladingen in het atoom in balans zijn. Daarom is het aantal elektronen gelijk aan het aantal protonen.[16]
Derde deel van Eight:
Voorspelling van chemische reacties
-
 1 Breng een chemische vergelijking in evenwicht. In een scheikundeles wordt van u verwacht dat u weet hoe u kunt voorspellen wat er gebeurt wanneer elementen worden gecombineerd. Op papier wordt dit chemische vereffeningsvergelijkingen genoemd.[17]
1 Breng een chemische vergelijking in evenwicht. In een scheikundeles wordt van u verwacht dat u weet hoe u kunt voorspellen wat er gebeurt wanneer elementen worden gecombineerd. Op papier wordt dit chemische vereffeningsvergelijkingen genoemd.[17] - Het formaat voor een chemische vergelijking bestaat uit reactanten aan de linkerkant van de vergelijking, dan een pijl in de richting van de producten van de vergelijking, dan de producten. De delen aan de ene kant van de vergelijking moeten de delen op de andere in evenwicht brengen.[18]
- Reactant 1 + Reagens 2 → Product 1 + Product 2
- Hier is een voorbeeld met de symbolen voor Tin, dat is Sn, in zijn geoxideerde vorm, dat is SnO2, gecombineerd met waterstofgas, dat wordt geschreven als H2. SnO2 + H2 → Sn + H2O.
- Maar deze vergelijking is niet in evenwicht omdat de hoeveelheid reactanten gelijk moet zijn aan de hoeveelheid producten. De linkerkant heeft nog een zuurstofatoom dan de rechterkant.[19]
- Gebruik basis wiskunde om de vergelijking in evenwicht te brengen door 2 waterstofeenheden aan de linkerkant van de vergelijking aan te duiden, en 2 watermoleculen aan de rechterkant. De uiteindelijke gebalanceerde vergelijking ziet er als volgt uit: SnO2 + 2 H2 → Sn + 2 H2O.[20]
-
 2 Denk anders over de vergelijkingen. Als u problemen ondervindt bij het in evenwicht houden van chemische vergelijkingen, beschouw de vergelijking dan als onderdeel van een recept, maar dan moet u deze aan beide kanten aanpassen, zodat u meer van uw recept kunt afnemen.
2 Denk anders over de vergelijkingen. Als u problemen ondervindt bij het in evenwicht houden van chemische vergelijkingen, beschouw de vergelijking dan als onderdeel van een recept, maar dan moet u deze aan beide kanten aanpassen, zodat u meer van uw recept kunt afnemen. - De vergelijking geeft je de ingrediënten aan de linkerkant van de vergelijking, maar vertelt je niet hoeveel te gebruiken van elk ingrediënt. De vergelijking vertelt je ook wat de producten zullen bevatten, maar vertelt je ook niet de hoeveelheid van de producten. Je moet dat uitzoeken.
- Gebruik het vorige voorbeeld, SnO2 + H2 → Sn + H2O, en bedenk waarom deze formule of receptformule niet werkt. De Sn-delen zijn aan beide zijden gelijk en de H2-delen zijn aan beide zijden gelijk. Maar de linkerkant heeft 2 zuurstofdelen en de rechterkant heeft slechts 1 zuurstof.
- Wijzig de rechterkant van de vergelijking om aan te geven dat het product 2 H2O-onderdelen bevat. De 2 voor de H2O betekent dat alle hoeveelheden in die groep nu zijn verdubbeld. Dus de zuurstof balanceert, maar het toevoegen van de 2 betekent dat er meer waterstof aan de rechterkant van de vergelijking staat dan aan de linkerkant. Ga terug naar links en verander het H2-ingrediënt tot tweemaal dat, door een 2 voor de H2 te plaatsen.
- Nu hebt u de ingrediënten aan beide kanten van de vergelijking aangepast. Wat gaat in het recept en wat eruit komt, zijn gelijk, of gebalanceerd.
-
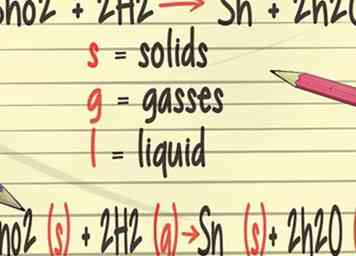 3 Voeg meer details toe aan uw uitgebalanceerde vergelijkingen. In je scheikunde leer je symbolen aan je evenwichtige vergelijkingen toe te voegen die de fysieke staat van de elementen weergeven. Deze symbolen bevatten (s) vaste stoffen, (g) voor gassen en (l) voor vloeistoffen.[21]
3 Voeg meer details toe aan uw uitgebalanceerde vergelijkingen. In je scheikunde leer je symbolen aan je evenwichtige vergelijkingen toe te voegen die de fysieke staat van de elementen weergeven. Deze symbolen bevatten (s) vaste stoffen, (g) voor gassen en (l) voor vloeistoffen.[21] -
 4 Identificeer veranderingen die optreden in een chemische reactie. Chemische reacties beginnen met de basiselementen, of al gecombineerde elementen, reactanten genoemd. Het combineren van twee of meer reagentia samen resulteert in een enkel product, of verschillende producten.
4 Identificeer veranderingen die optreden in een chemische reactie. Chemische reacties beginnen met de basiselementen, of al gecombineerde elementen, reactanten genoemd. Het combineren van twee of meer reagentia samen resulteert in een enkel product, of verschillende producten. - Om de chemie te halen, moet je weten hoe je vergelijkingen moet oplossen waarbij chemische reactanten, producten en de introductie van een andere invloed betrokken zijn die de reactanten, producten of beide verandert.[22]
Deel vier van de acht:
Identificatie van chemische reacties
-
 1 Herken de soorten reacties. Chemische reacties kunnen optreden als gevolg van vele invloeden, naast het eenvoudig combineren van ingrediënten.
1 Herken de soorten reacties. Chemische reacties kunnen optreden als gevolg van vele invloeden, naast het eenvoudig combineren van ingrediënten. - Veel voorkomende soorten chemische reacties die u kunt verwachten te leren, zijn onder meer synthese, analyse, substitutie, dubbele verplaatsing, zuur-base, oxidatie-reductie, verbranding, isomerisatie en hydrolyse.[23]
- De soorten reacties in je scheikundeles kunnen variëren, afhankelijk van de doelen van elke klas. Chemie op middelbare school levert misschien niet hetzelfde detailniveau op als dat van scheikunde aan een hogeschool of universiteit.
-
 2 Gebruik de verstrekte hulpmiddelen. Je zult de verschillen in elk soort reactie in je klas moeten begrijpen. Gebruik bronnen die door je docent of professor ter beschikking zijn gesteld om de verschillende soorten reacties te begrijpen die in je klas worden behandeld. Wees niet bang om vragen te stellen.
2 Gebruik de verstrekte hulpmiddelen. Je zult de verschillen in elk soort reactie in je klas moeten begrijpen. Gebruik bronnen die door je docent of professor ter beschikking zijn gesteld om de verschillende soorten reacties te begrijpen die in je klas worden behandeld. Wees niet bang om vragen te stellen. - Het begrijpen van de veranderingen die plaatsvinden met verschillende soorten chemische reacties kan verwarrend zijn. Het begrijpen van wat er gebeurt tijdens specifieke chemische reacties kan een uitdagend onderdeel van je scheikundeles zijn.
-
 3 Denk logisch na over chemische reacties. Probeer het niet moeilijker te maken dan het al is door verstrikt te raken in de terminologie.De soorten chemische reacties waarover je leert, zijn gewoon iets doen om iets te veranderen.
3 Denk logisch na over chemische reacties. Probeer het niet moeilijker te maken dan het al is door verstrikt te raken in de terminologie.De soorten chemische reacties waarover je leert, zijn gewoon iets doen om iets te veranderen. - Je weet bijvoorbeeld al wat er gebeurt als je 2 waterstofatomen combineert met 1 zuurstofatoom, dan krijg je water. Dus als je dat water zet dat je zojuist in een pot hebt gezet en het met warmte op het vuur zet, verandert er iets. Je hebt een chemische reactie gecreëerd. Als je dat water in de vriezer steekt, hetzelfde. Je hebt een verandering geïntroduceerd die de oorspronkelijke reactant veranderde, water in dit geval.
- Ga elk type reactie een voor een voorbij totdat je het begrijpt en ga dan verder met het volgende type. Focus op de energiebron die de reactie aanstuurt, en de primaire veranderingen die daaruit voortvloeien.
- Als je problemen hebt op dit gebied, maak dan een lijst van wat je verwarrend vindt, en bespreek het met je professor, je studiegroep of iemand die de chemie goed kent.
Vijfde deel van Eight:
De taal van de chemie gebruiken
-
 1 Leer hoe verbindingen worden genoemd. Chemie heeft zijn eigen regels voor nomenclatuur. De soorten reacties die plaatsvinden met chemische verbindingen, het verlies of de winst van elektronen in hun buitenste schil, en de stabiliteit of instabiliteit van verbindingen maken deel uit van de chemienomenclatuur.
1 Leer hoe verbindingen worden genoemd. Chemie heeft zijn eigen regels voor nomenclatuur. De soorten reacties die plaatsvinden met chemische verbindingen, het verlies of de winst van elektronen in hun buitenste schil, en de stabiliteit of instabiliteit van verbindingen maken deel uit van de chemienomenclatuur. -
 2 Neem het gedeelte over nomenclatuur serieus. De meeste beginnende chemielessen hebben een gedeelte dat alleen gewijd is aan nomenclatuur. Op sommige scholen betekent het niet halen van het nomenclatuurgedeelte van de klas dat de klas tekortschiet.
2 Neem het gedeelte over nomenclatuur serieus. De meeste beginnende chemielessen hebben een gedeelte dat alleen gewijd is aan nomenclatuur. Op sommige scholen betekent het niet halen van het nomenclatuurgedeelte van de klas dat de klas tekortschiet. - Werk zo mogelijk aan nomenclatuur voordat u daadwerkelijk met de klas begint. Veel werkmappen zijn beschikbaar voor aankoop of via online toegang.
-
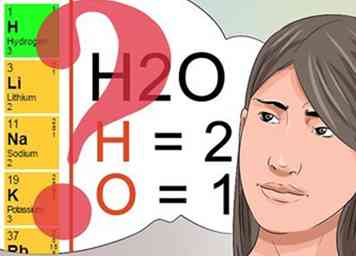 3 Weet wat superscript- en subscriptnummers aangeven. Begrijpen wat superscript- en subscript-cijfers betekenen, is van cruciaal belang voor het behalen van je scheikundeles.[24]
3 Weet wat superscript- en subscriptnummers aangeven. Begrijpen wat superscript- en subscript-cijfers betekenen, is van cruciaal belang voor het behalen van je scheikundeles.[24] - De superscriptnummers volgen een patroon in het periodiek systeem en geven de algehele lading van het element of de chemische verbinding aan. Bekijk het periodiek systeem om elementen in verticale rijen weer te geven die dezelfde superscriptnummers delen.
- Subscriptnummers worden gebruikt om de hoeveelheid van elk geïdentificeerd element te identificeren dat deel uitmaakt van de chemische verbinding. Zoals eerder besproken, vertelt het subscript van 2 in het molecuul H2O dat er 2 waterstofatomen zijn als onderdeel van dat molecuul.
-
 4 Herken hoe atomen met elkaar reageren. Een deel van de nomenclatuur die wordt gebruikt in de chemie omvat specifieke regels voor het benoemen van de producten van specifieke soorten reacties.[25]
4 Herken hoe atomen met elkaar reageren. Een deel van de nomenclatuur die wordt gebruikt in de chemie omvat specifieke regels voor het benoemen van de producten van specifieke soorten reacties.[25] - Een van die reacties is de oxidatiereductiereactie. Deze reactie omvat het proces van het winnen of verliezen van elektronen.
- Een eenvoudige manier om het proces te onthouden is om de uitdrukking "LEO the lion says GER" te onthouden. Dit staat voor Lose Electrons in Oxidation, and Gain Electrons in Reduction.[26]
-
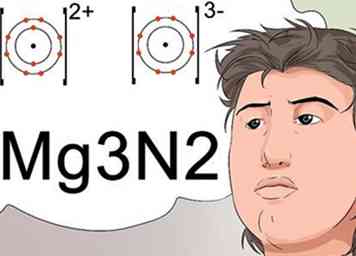 5 Erken dat subscripts de formule voor een stabiele lading op een verbinding kunnen aangeven. Wetenschappers gebruiken subscripts om de uiteindelijke molecuulformule van een verbinding te identificeren, wat ook een stabiele verbinding met een neutrale lading aangeeft.
5 Erken dat subscripts de formule voor een stabiele lading op een verbinding kunnen aangeven. Wetenschappers gebruiken subscripts om de uiteindelijke molecuulformule van een verbinding te identificeren, wat ook een stabiele verbinding met een neutrale lading aangeeft. - Om een neutrale lading te maken, moet het positief geladen ion, een kation genaamd, worden gebalanceerd door een gelijke lading van een negatief ion, een anion genoemd. De kosten worden geïdentificeerd als superscripts.[27]
- Het magnesiumion draagt bijvoorbeeld een +2 kationlading en het stikstofion heeft een -3-anionlading. De +2 en -3 worden aangeduid als superscript. Om de twee elementen goed te combineren om tot een neutrale lading te komen, worden 3 magnesiumatomen gebruikt voor elke 2 stikstofproducten.[28]
- De nomenclatuur die dit identificeert, gebruikt subscripts en wordt geschreven als Mg3N2.[29]
-
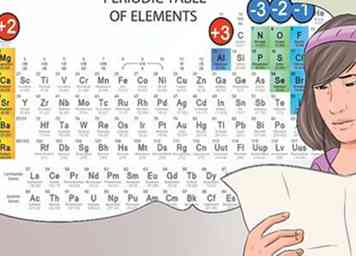 6 Identificeer anionen en kationen van hun positie op het periodiek systeem. De elementen op het periodiek systeem die in de eerste kolom met elementen vallen, worden beschouwd als alkaliën en vormen +1 kationladingen. Bijvoorbeeld Na + en Li +.[30]
6 Identificeer anionen en kationen van hun positie op het periodiek systeem. De elementen op het periodiek systeem die in de eerste kolom met elementen vallen, worden beschouwd als alkaliën en vormen +1 kationladingen. Bijvoorbeeld Na + en Li +.[30] - De aardalkalimetalen in de tweede kolom vormen 2+ kationen, zoals Mg2 + en Ba2 +.[31]
- Elementen in de zevende kolom worden halogenen genoemd en vormen -1-anionen, zoals Cl- en I-.[32]
-
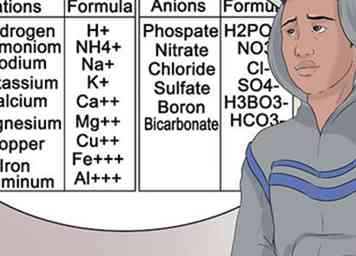 7 Leer de meer algemene anionen en kationen te herkennen. Om u te helpen uw scheikunde-klasse te doorstaan, moet u zo vertrouwd mogelijk zijn met de nomenclatuur die is gekoppeld aan groepen elementen. Dit type superscript verandert niet.[33]
7 Leer de meer algemene anionen en kationen te herkennen. Om u te helpen uw scheikunde-klasse te doorstaan, moet u zo vertrouwd mogelijk zijn met de nomenclatuur die is gekoppeld aan groepen elementen. Dit type superscript verandert niet.[33] - Met andere woorden, magnesium wordt altijd weergegeven als Mg en draagt altijd een kationlading van +2.[34]
-
 8 Denk aan scheikunde als het leren van een nieuwe taal. Begrijp dat de geschreven vormen van het aangeven van ladingen, het aantal atomen in een molecuul en de bindingen gevormd om moleculen bij elkaar te houden, allemaal deel uitmaken van de taal van de chemie. Dit alles is een geschreven manier om aan te geven wat er gebeurt in de chemische reacties die niet echt kunnen worden gezien.
8 Denk aan scheikunde als het leren van een nieuwe taal. Begrijp dat de geschreven vormen van het aangeven van ladingen, het aantal atomen in een molecuul en de bindingen gevormd om moleculen bij elkaar te houden, allemaal deel uitmaken van de taal van de chemie. Dit alles is een geschreven manier om aan te geven wat er gebeurt in de chemische reacties die niet echt kunnen worden gezien. - Het zou zoveel makkelijker te begrijpen zijn als alles zichtbaar was, recht voor je. Maar naast het begrijpen van alle scheikunde die er is, moet je ook de taal begrijpen die wordt gebruikt om alles wat met chemie te maken heeft vast te leggen en te representeren.
- Als begrijpen van chemie moeilijk voor je is, besef dan dat je niet alleen bent, maar laat het je niet slaan. Praat met je professor, je studiegroep, een onderwijsassistent of iemand die heel goed is in scheikunde. Je kunt dit allemaal leren, maar het kan helpen als het kan worden uitgelegd op een manier die voor jou logisch is.
Deel Zes van Acht:
De wiskunde doen
-
 1 Ken de volgorde voor elementaire wiskundige berekeningen. In de chemie zijn soms zeer gedetailleerde berekeningen nodig, maar soms zijn alleen basisvaardigheden voor wiskunde voldoende. Het is belangrijk om de juiste volgorde te begrijpen voor het voltooien van berekeningen in een vergelijking.[35]
1 Ken de volgorde voor elementaire wiskundige berekeningen. In de chemie zijn soms zeer gedetailleerde berekeningen nodig, maar soms zijn alleen basisvaardigheden voor wiskunde voldoende. Het is belangrijk om de juiste volgorde te begrijpen voor het voltooien van berekeningen in een vergelijking.[35] - Onthoud een nuttige zin. De zin "Excuseer mijn geliefde tante Sally" vertelt u welke toepassingen het eerst moeten worden uitgevoerd. De eerste letter van elk woord geeft de volgorde aan die moet worden gebruikt.Alles in haakjes wordt eerst gedaan, daarna Exponentiation, Multiplication of Division, the Lastly Addance of Subtraction.
- Voltooi de berekening 3 + 2 x 6 = ___, door uw stappen volgens de zin te ordenen. Het antwoord op de vergelijking is 15.
-
 2 Wees comfortabel en rond heel grote aantallen af. Hoewel het afronden van getallen niet uniek is voor chemie, resulteren de antwoorden op enkele van de complexe wiskundige vergelijkingen in getallen die te lang zijn om te schrijven. Besteed veel aandacht aan de aanwijzingen die worden gegeven bij het afronden van uw antwoorden.[36]
2 Wees comfortabel en rond heel grote aantallen af. Hoewel het afronden van getallen niet uniek is voor chemie, resulteren de antwoorden op enkele van de complexe wiskundige vergelijkingen in getallen die te lang zijn om te schrijven. Besteed veel aandacht aan de aanwijzingen die worden gegeven bij het afronden van uw antwoorden.[36] - Weet waar je moet afronden. Als het cijfer volgende in de reeks een 4 of minder is, dan naar beneden afgerond, en als het een 5 of hoger ronde is. Beschouw bijvoorbeeld het nummer 6.66666666666666. U wordt gevraagd om uw antwoord op de tweede decimaal af te ronden. Het antwoord is 6.67.[37]
-
 3 Begrijp de absolute waarde. In de chemie worden sommige getallen absolute waarde genoemd, en niet hun echte wiskundige waarde. Absolute waarde is de afstand van het getal tot nul.
3 Begrijp de absolute waarde. In de chemie worden sommige getallen absolute waarde genoemd, en niet hun echte wiskundige waarde. Absolute waarde is de afstand van het getal tot nul. - Met andere woorden, u beschouwt niet langer positief of negatief, alleen de afstand tot nul. De absolute waarde van -20 is bijvoorbeeld 20.[38]
-
 4 Zorg dat u bekend bent met de geaccepteerde maateenheden. Hier zijn een paar voorbeelden.
4 Zorg dat u bekend bent met de geaccepteerde maateenheden. Hier zijn een paar voorbeelden. - Materiematen worden uitgedrukt in mol (mol).
- De temperatuur wordt uitgedrukt in graden Fahrenheit (° F), Kelvin (° K) of Celsius (° C).
- De massa wordt uitgedrukt in gram (g), kilogram (kg) of milligram (mg).
- Vloeibare maatregelen worden uitgedrukt in liters (L) of milliliters (mls).
-
 5 Oefen het omzetten van de ene schaal naar de andere. Een deel van het slagen voor je scheikunde-les zal het maken van conversies van de ene geaccepteerde schaal naar de andere omvatten. Dit kan het veranderen van de ene temperatuurmeting in de andere omvatten, het veranderen van kilo's in kilogrammen en ons gewicht in liters.
5 Oefen het omzetten van de ene schaal naar de andere. Een deel van het slagen voor je scheikunde-les zal het maken van conversies van de ene geaccepteerde schaal naar de andere omvatten. Dit kan het veranderen van de ene temperatuurmeting in de andere omvatten, het veranderen van kilo's in kilogrammen en ons gewicht in liters. - Mogelijk wordt u gevraagd antwoorden te geven in andere eenheden dan die in de oorspronkelijke vraag stonden. U kunt bijvoorbeeld een temperatuurvergelijking krijgen om op te lossen in Celsius en u wordt gevraagd het laatste antwoord in Kelvin te geven.
- Kelvin is de internationale standaard voor temperatuurmetingen die vaak worden gebruikt in chemische reacties. Oefen het veranderen van graden Celsius naar graden Kelvin of Fahrenheit.
-
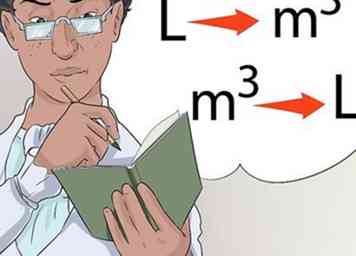 6 Neem de tijd om te oefenen. Terwijl je wordt blootgesteld aan verschillende conversies in je klas, neem je de tijd om te leren hoe je van de een naar de ander kunt converteren en weer terug.
6 Neem de tijd om te oefenen. Terwijl je wordt blootgesteld aan verschillende conversies in je klas, neem je de tijd om te leren hoe je van de een naar de ander kunt converteren en weer terug. -
 7 Weet hoe je concentraties moet berekenen. Verbeter je basisvaardigheden in wiskunde op het gebied van percentages, verhoudingen en verhoudingen.
7 Weet hoe je concentraties moet berekenen. Verbeter je basisvaardigheden in wiskunde op het gebied van percentages, verhoudingen en verhoudingen. -
 8 Oefen met voedingsetiketten op voedingsproducten. Om de chemie te halen, moet je comfortabel zijn bij het berekenen van verhoudingen, verhoudingen, percentages en dan weer terug. Als dit moeilijk voor je is, oefen dan met het gebruik van andere gemeenschappelijke maateenheden, zoals die op voedseletiketten.
8 Oefen met voedingsetiketten op voedingsproducten. Om de chemie te halen, moet je comfortabel zijn bij het berekenen van verhoudingen, verhoudingen, percentages en dan weer terug. Als dit moeilijk voor je is, oefen dan met het gebruik van andere gemeenschappelijke maateenheden, zoals die op voedseletiketten. - Kijk naar het voedingsetiket op elk voedingsproduct. U ziet calorieën per portie, procent van de RDA's, totaal vet, calorieën uit vet, totale koolhydraten en een uitsplitsing van de verschillende soorten koolhydraten. Oefen door verschillende verhoudingen en verhoudingen te berekenen met verschillende categorieën voor het laagste getal.
- Bereken bijvoorbeeld de hoeveelheid enkelvoudig onverzadigd vet per totale hoeveelheid vet. Wijzig dit in een percentage. Bereken het aantal calorieën in de hele container met behulp van de opgegeven aantallen voor calorieën per portie en porties per container. Bereken hoeveel natrium in ½ van de volle container zit.
- Door conversies zoals deze toe te passen, ongeacht de gebruikte eenheden, zult u veel comfortabeler zijn in het uitwisselen van deze maateenheden voor chemiemetingen, zoals mollen per liter of gram per ml, enz.
-
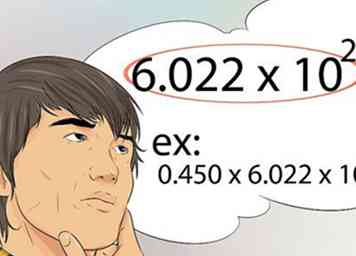 9 Weet hoe u het nummer van Avogadro moet gebruiken. Dit is het getal dat het aantal moleculen, atomen of deeltjes weergeeft, die in één mol worden gevonden. Het nummer van Avogrado is 6.022x10 23.[39]
9 Weet hoe u het nummer van Avogadro moet gebruiken. Dit is het getal dat het aantal moleculen, atomen of deeltjes weergeeft, die in één mol worden gevonden. Het nummer van Avogrado is 6.022x10 23.[39] - Bijvoorbeeld, 0,450 mol Fe bevat hoeveel atomen? Het antwoord is 0.450 x 6.022x10 23.[40]
-
 10 Denk aan wortels. Als u moeite heeft om te begrijpen hoe u het getal van Avogadro kunt toepassen, denk dan in termen van wortels in plaats van atomen, moleculen of deeltjes. Hoeveel wortels zijn er in een dozijn? Nou, je weet dat een dozijn 12 van iets bevat, dus er zijn 12 wortels in een dozijn.
10 Denk aan wortels. Als u moeite heeft om te begrijpen hoe u het getal van Avogadro kunt toepassen, denk dan in termen van wortels in plaats van atomen, moleculen of deeltjes. Hoeveel wortels zijn er in een dozijn? Nou, je weet dat een dozijn 12 van iets bevat, dus er zijn 12 wortels in een dozijn. - Beantwoord nu de vraag, hoeveel wortels zitten er in een mol? In plaats van te vermenigvuldigen met 12, gebruikt u meerdere met Avogadro's nummer. Er zijn dus 6.022 x 1023 wortelen in één mol.
- Het getal van Avogadro wordt gebruikt om alles van substantie, een atoom, molecule, deeltje of wortel om te zetten naar hoeveel van dat ding in één mol zit.
- Als u het aantal mollen van iets weet, is de uiteindelijke waarde voor het aantal aanwezige moleculen, atomen of deeltjes dat aantal keer Avogrado's getal.[41]
- Inzicht in het omzetten van deeltjes naar moedervlekken is een belangrijk onderdeel van de passerende chemie. Moleconversies zijn een onderdeel van het berekenen van verhoudingen en verhoudingen. Dit betekent de hoeveelheid iets in mollen als onderdeel van iets anders.
-
 11 Concentreer je op het begrijpen van Molarity. Overweeg het aantal mollen van iets dat zich in een vloeibare omgeving bevindt. Dit voorbeeld is belangrijk om te begrijpen, omdat we het nu over Molarity hebben, of het aandeel van iets uitgedrukt als mollen per liter.
11 Concentreer je op het begrijpen van Molarity. Overweeg het aantal mollen van iets dat zich in een vloeibare omgeving bevindt. Dit voorbeeld is belangrijk om te begrijpen, omdat we het nu over Molarity hebben, of het aandeel van iets uitgedrukt als mollen per liter. - Molariteit wordt vaak gebruikt in de chemie om de hoeveelheid iets in een vloeibare omgeving uit te drukken, of de hoeveelheid opgeloste stof in een vloeibare oplossing. De molariteit wordt berekend door het aantal opgeloste stoffen te delen door de liters oplossing. Molariteit wordt uitgedrukt als mol per liter.[42]
- Bereken de dichtheid. Dichtheid is ook een veelgebruikte maatstaf in de chemie. Dichtheid is de maateenheid voor de massa per volume-eenheid van een chemische stof. De meest voorkomende uitdrukking voor dichtheid wordt gegeven in gram per milliliter, of gram per kubieke centimeter, wat hetzelfde is.[43]
-
 12 Converteer vergelijkingen naar hun empirische formule. Dit betekent dat definitieve antwoorden voor vergelijkingen als verkeerd worden beschouwd, tenzij je ze hebt opgesplitst in hun eenvoudigste vorm.[44]
12 Converteer vergelijkingen naar hun empirische formule. Dit betekent dat definitieve antwoorden voor vergelijkingen als verkeerd worden beschouwd, tenzij je ze hebt opgesplitst in hun eenvoudigste vorm.[44] - Dit is niet van toepassing op moleculaire formules, omdat dit type beschrijving u de exacte verhoudingen van chemische elementen waaruit het molecuul bestaat, vertelt.[45]
-
 13 Weet wat er in een moleculaire formule zit. Je verandert een molecuulformule niet in zijn eenvoudigste of empirische vorm, omdat de molecuulformule je precies vertelt wat het molecuul vormt.
13 Weet wat er in een moleculaire formule zit. Je verandert een molecuulformule niet in zijn eenvoudigste of empirische vorm, omdat de molecuulformule je precies vertelt wat het molecuul vormt. - Een molecuulformule is geschreven in een taal die de afkorting van het element (en) gebruikt en het aantal atomen van elk element dat het molecuul vormt.
- De moleculaire formule voor water is bijvoorbeeld H2O. Dit betekent dat elk watermolecuul 2 waterstofatomen en 1 zuurstofatoom bevat. De moleculaire formule voor acetaminophen is C8H9NO2. Elke chemische verbinding wordt vertegenwoordigd door zijn moleculaire formule.
-
 14 Overweeg chemie wiskunde als stoichiometrie. Je zult deze term waarschijnlijk tegenkomen. Het is een beschrijving van de manier waarop chemie tot uitdrukking wordt gebracht met behulp van wiskundige formules. Met behulp van scheikunde wiskunde, of stoichiometrie, worden waarden van elementen en chemische verbindingen vaak weergegeven in termen van mol, mol%, mol per liter, of mol per kg.[46]
14 Overweeg chemie wiskunde als stoichiometrie. Je zult deze term waarschijnlijk tegenkomen. Het is een beschrijving van de manier waarop chemie tot uitdrukking wordt gebracht met behulp van wiskundige formules. Met behulp van scheikunde wiskunde, of stoichiometrie, worden waarden van elementen en chemische verbindingen vaak weergegeven in termen van mol, mol%, mol per liter, of mol per kg.[46] - Als gewone wiskundeprocedure moet je gram omzetten in moedervlekken. De atomaire massa-eenheid van een element, in grammen, is gelijk aan één mol van die stof. Calcium heeft bijvoorbeeld een massa van 40 atomaire massa-eenheden. Daarom is 40 gram calcium gelijk aan één mol calcium.[47]
-
 15 Vraag om aanvullende voorbeelden. Als de wiskundige vergelijkingen en conversies niet gemakkelijk voor je zijn, praat dan met je docent of professor. Vraag om meer problemen die je alleen kunt oplossen, tot de betrokken concepten en alle factoren van conversie voor jou logisch zijn.
15 Vraag om aanvullende voorbeelden. Als de wiskundige vergelijkingen en conversies niet gemakkelijk voor je zijn, praat dan met je docent of professor. Vraag om meer problemen die je alleen kunt oplossen, tot de betrokken concepten en alle factoren van conversie voor jou logisch zijn.
Deel Zeven van Acht:
Goede studie-gewoonten ontwikkelen
-
 1 Vorm of word lid van een studiegroep. Schaam je niet als chemie moeilijk voor je is. Het is een moeilijk onderwerp voor bijna iedereen.
1 Vorm of word lid van een studiegroep. Schaam je niet als chemie moeilijk voor je is. Het is een moeilijk onderwerp voor bijna iedereen. - Door in groepen te werken, zullen sommige leden gebieden gemakkelijker vinden dan andere en kunnen ze hun leermethoden delen met de groep. Verdeel en heers.
-
 2 Lees alle hoofdstukken in je chemieboek. Het lezen van een scheikundeboek is niet altijd het meest interessante boek op de plank. Maar neem de tijd om de toegewezen secties te lezen en markeer de delen die gewoon niet logisch lijken. Probeer een lijst met vragen of concepten te maken die u moeilijk begrijpt.
2 Lees alle hoofdstukken in je chemieboek. Het lezen van een scheikundeboek is niet altijd het meest interessante boek op de plank. Maar neem de tijd om de toegewezen secties te lezen en markeer de delen die gewoon niet logisch lijken. Probeer een lijst met vragen of concepten te maken die u moeilijk begrijpt. - Ga later terug naar die delen en kijk opnieuw. Als ze nog steeds verwarrend lijken, praat dan met je studiegroep, je professor of een onderwijsassistent.
- Probeer de vragen aan het einde van het hoofdstuk te beantwoorden. De meeste studieboeken bevatten aanvullende informatie die de juiste antwoorden uitlegt voor het geval iets u verwarrend is.
- Leerboeken gebruiken visuele hulpmiddelen om de belangrijkste leerpunten over te brengen. Kijk naar de beelden en let op de bijschriften. Dit kan een deel van de verwarring helpen wegnemen.
-
 3 Vraag toestemming om de lezingen op te nemen. Aantekeningen maken en alles bekijken wat de leraar op planken of overhead schrijft, is moeilijk om te doen, vooral in een moeilijk onderwerp als scheikunde. Als u een opname hebt die u steeds opnieuw kunt beluisteren, kunt u het gemakkelijker voor u maken om het te begrijpen. U moet echter altijd toestemming vragen om de colleges op te nemen voordat u dit doet.
3 Vraag toestemming om de lezingen op te nemen. Aantekeningen maken en alles bekijken wat de leraar op planken of overhead schrijft, is moeilijk om te doen, vooral in een moeilijk onderwerp als scheikunde. Als u een opname hebt die u steeds opnieuw kunt beluisteren, kunt u het gemakkelijker voor u maken om het te begrijpen. U moet echter altijd toestemming vragen om de colleges op te nemen voordat u dit doet. - Probeer iets te zeggen als: "Ik vind het gemakkelijker om te studeren als ik de lezing opnieuw kan horen terwijl ik mijn aantekeningen bekijk. Zou het goed zijn als ik je colleges opneem, zodat ik dat kan? "
-
 4 Toegang tot oude tests of studiegidsen. De meeste natuurwetenschappelijke cursussen, zoals scheikunde, bieden toegang tot eerdere testvragen om studenten te helpen zich voor te bereiden op grote tests.
4 Toegang tot oude tests of studiegidsen. De meeste natuurwetenschappelijke cursussen, zoals scheikunde, bieden toegang tot eerdere testvragen om studenten te helpen zich voor te bereiden op grote tests. - Vermijd gewoon het onthouden van de antwoorden. Scheikunde is een onderwerp dat je moet begrijpen om diezelfde vraag te beantwoorden als deze anders geformuleerd is.
Deel Acht van Acht:
Hulp krijgen
-
 1 Maak kennis met je professor of leraar. Om de chemie met het best mogelijke cijfer te halen, neem je de tijd om de persoon te ontmoeten die de les geeft. Als je het moeilijk hebt, laat hen dan weten dat dit moeilijk voor je is. Maar zelfs als het goed met je gaat, is het een goed idee om de professor te leren kennen.
1 Maak kennis met je professor of leraar. Om de chemie met het best mogelijke cijfer te halen, neem je de tijd om de persoon te ontmoeten die de les geeft. Als je het moeilijk hebt, laat hen dan weten dat dit moeilijk voor je is. Maar zelfs als het goed met je gaat, is het een goed idee om de professor te leren kennen. - Veel professoren hebben studiegidsen beschikbaar en openen extra kantooruren voor studentenhulp wanneer dat nodig is.
- Houd een lijst bij van moeilijk bereikbare gebieden en vraag uw professor of docent om hulp. Dit geeft je de mogelijkheid om de moeilijke onderwerpen te begrijpen voordat de klas verdergaat naar het volgende gedeelte, en je raakt nog meer in de war.
-
 2 Bezoek onlinehulpbronnen. Besteed aandacht aan online bronnen of links die worden aangeboden door de afdeling scheikunde van uw eigen school.
2 Bezoek onlinehulpbronnen. Besteed aandacht aan online bronnen of links die worden aangeboden door de afdeling scheikunde van uw eigen school. -
 3 Probeer niet overweldigd te raken. De gedetailleerde informatie over de verschillende soorten chemische reacties, het delen van elektronen, het veranderen van de lading van een element of een samenstelling en het weten wat de verschillende soorten reacties doen, kan zeer verwarrend zijn.
3 Probeer niet overweldigd te raken. De gedetailleerde informatie over de verschillende soorten chemische reacties, het delen van elektronen, het veranderen van de lading van een element of een samenstelling en het weten wat de verschillende soorten reacties doen, kan zeer verwarrend zijn. - Breek gebieden uit die moeilijk zijn in beschrijfbare termen. U kunt bijvoorbeeld verbaliseren dat u geen oxidatiereacties begrijpt of elementen combineert met positieve en negatieve ladingen. Door de gebieden te verbaliseren die je moeilijk begrijpt, kun je ook enige geruststelling vinden als je je realiseert dat er veel is dat je hebt geleerd en begrijpt.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Begin met de meest elementaire structuren. Om je scheikunde klas te halen, moet je een goed begrip hebben van de bouwstenen die alles vormen wat substantie of massa heeft.
1 Begin met de meest elementaire structuren. Om je scheikunde klas te halen, moet je een goed begrip hebben van de bouwstenen die alles vormen wat substantie of massa heeft.  2 Grijp het concept van een atoom. Een atoom wordt beschouwd als de kleinste bouwsteen van alles dat massa heeft, inclusief dingen die we niet altijd kunnen zien, zoals gassen. Maar zelfs het kleine atoom heeft nog kleinere delen waaruit zijn structuur bestaat.[1]
2 Grijp het concept van een atoom. Een atoom wordt beschouwd als de kleinste bouwsteen van alles dat massa heeft, inclusief dingen die we niet altijd kunnen zien, zoals gassen. Maar zelfs het kleine atoom heeft nog kleinere delen waaruit zijn structuur bestaat.[1]  3 Het atomaire raamwerk van een element begrijpen. Een element wordt beschouwd als een stof in de natuur die niet kan worden opgesplitst in andere elementen, of in een eenvoudiger vorm. Elementen zijn gemaakt van atomen.[4]
3 Het atomaire raamwerk van een element begrijpen. Een element wordt beschouwd als een stof in de natuur die niet kan worden opgesplitst in andere elementen, of in een eenvoudiger vorm. Elementen zijn gemaakt van atomen.[4]  4 Begrijp meer over de kern. De neutronen, gevonden in de kern, zijn neutraal belast. Protonen hebben een positieve lading. Het atoomnummer van een element is exact hetzelfde als het aantal protonen in de kern.[6]
4 Begrijp meer over de kern. De neutronen, gevonden in de kern, zijn neutraal belast. Protonen hebben een positieve lading. Het atoomnummer van een element is exact hetzelfde als het aantal protonen in de kern.[6]  5 Herken Lewis-diagrammen. Lewis-diagrammen worden soms elektronenpuntdiagrammen genoemd. Dit zijn eenvoudige diagrammen die stippen gebruiken om de gepaarde en ongepaarde elektronen in de buitenste schil van een atoom weer te geven.[7]
5 Herken Lewis-diagrammen. Lewis-diagrammen worden soms elektronenpuntdiagrammen genoemd. Dit zijn eenvoudige diagrammen die stippen gebruiken om de gepaarde en ongepaarde elektronen in de buitenste schil van een atoom weer te geven.[7]  6 Weet wat de octetregel betekent. Lewis-diagrammen werken op de octet-regel, die stelt dat atomen stabiel zijn wanneer ze toegang hebben tot acht elektronen in de buitenste schil. Waterstof is de uitzondering en wordt als stabiel beschouwd met twee elektronen in de buitenste schil.[9]
6 Weet wat de octetregel betekent. Lewis-diagrammen werken op de octet-regel, die stelt dat atomen stabiel zijn wanneer ze toegang hebben tot acht elektronen in de buitenste schil. Waterstof is de uitzondering en wordt als stabiel beschouwd met twee elektronen in de buitenste schil.[9]  7 Teken een Lewis-diagram. Het symbool voor een element, omgeven door een rangschikking van punten, is een Lewis-diagram. Beschouw het diagram als een stilstaand beeld van een film. In plaats van dat de elektronen rond de buitenkant van het element ronddraaien, worden ze weergegeven als een vast moment in de tijd.[10]
7 Teken een Lewis-diagram. Het symbool voor een element, omgeven door een rangschikking van punten, is een Lewis-diagram. Beschouw het diagram als een stilstaand beeld van een film. In plaats van dat de elektronen rond de buitenkant van het element ronddraaien, worden ze weergegeven als een vast moment in de tijd.[10]  8 Begrijp de rangschikking van elektronen terwijl ze elementen aan elkaar binden. De Lewis-diagrammen zijn een simplistische visuele weergave van wat er wordt begrepen over chemische bindingen.
8 Begrijp de rangschikking van elektronen terwijl ze elementen aan elkaar binden. De Lewis-diagrammen zijn een simplistische visuele weergave van wat er wordt begrepen over chemische bindingen.  1 Kijk naar het periodiek systeem. Als u problemen ondervindt met de eigenschappen van elementen, besteed dan enige tijd aan het doornemen van elk beschikbaar materiaal in het periodiek systeem. Het belangrijkste is om er goed naar te kijken.
1 Kijk naar het periodiek systeem. Als u problemen ondervindt met de eigenschappen van elementen, besteed dan enige tijd aan het doornemen van elk beschikbaar materiaal in het periodiek systeem. Het belangrijkste is om er goed naar te kijken.  4 Zoek de atomaire massa van elk element. Het getal onderaan is de atoommassa. Onthoud dat het aantal protonen in combinatie met het aantal neutronen in de kern gelijk is aan het atomaire massagetal.[14]
4 Zoek de atomaire massa van elk element. Het getal onderaan is de atoommassa. Onthoud dat het aantal protonen in combinatie met het aantal neutronen in de kern gelijk is aan het atomaire massagetal.[14]  5 Bereken het aantal neutronen gevonden in de kern. U kunt de cijfers op het periodiek systeem gebruiken om dit uit te zoeken. Het atoomnummer voor elk element is exact hetzelfde als het aantal protonen dat in de kern wordt gevonden.
5 Bereken het aantal neutronen gevonden in de kern. U kunt de cijfers op het periodiek systeem gebruiken om dit uit te zoeken. Het atoomnummer voor elk element is exact hetzelfde als het aantal protonen dat in de kern wordt gevonden.  6 Bereken het aantal elektronen. Onthoud dat tegenpolen elkaar aantrekken. Elektronen zijn positief geladen deeltjes die rond de kern van atoomachtige planeten rond de zon vliegen. Het aantal negatief geladen elektronen dat naar de kern wordt getrokken, hangt af van het aantal positief geladen protonen in de kern.
6 Bereken het aantal elektronen. Onthoud dat tegenpolen elkaar aantrekken. Elektronen zijn positief geladen deeltjes die rond de kern van atoomachtige planeten rond de zon vliegen. Het aantal negatief geladen elektronen dat naar de kern wordt getrokken, hangt af van het aantal positief geladen protonen in de kern.  1 Breng een chemische vergelijking in evenwicht. In een scheikundeles wordt van u verwacht dat u weet hoe u kunt voorspellen wat er gebeurt wanneer elementen worden gecombineerd. Op papier wordt dit chemische vereffeningsvergelijkingen genoemd.[17]
1 Breng een chemische vergelijking in evenwicht. In een scheikundeles wordt van u verwacht dat u weet hoe u kunt voorspellen wat er gebeurt wanneer elementen worden gecombineerd. Op papier wordt dit chemische vereffeningsvergelijkingen genoemd.[17]  2 Denk anders over de vergelijkingen. Als u problemen ondervindt bij het in evenwicht houden van chemische vergelijkingen, beschouw de vergelijking dan als onderdeel van een recept, maar dan moet u deze aan beide kanten aanpassen, zodat u meer van uw recept kunt afnemen.
2 Denk anders over de vergelijkingen. Als u problemen ondervindt bij het in evenwicht houden van chemische vergelijkingen, beschouw de vergelijking dan als onderdeel van een recept, maar dan moet u deze aan beide kanten aanpassen, zodat u meer van uw recept kunt afnemen. 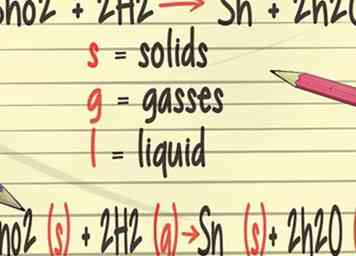 3 Voeg meer details toe aan uw uitgebalanceerde vergelijkingen. In je scheikunde leer je symbolen aan je evenwichtige vergelijkingen toe te voegen die de fysieke staat van de elementen weergeven. Deze symbolen bevatten (s) vaste stoffen, (g) voor gassen en (l) voor vloeistoffen.[21]
3 Voeg meer details toe aan uw uitgebalanceerde vergelijkingen. In je scheikunde leer je symbolen aan je evenwichtige vergelijkingen toe te voegen die de fysieke staat van de elementen weergeven. Deze symbolen bevatten (s) vaste stoffen, (g) voor gassen en (l) voor vloeistoffen.[21]  4 Identificeer veranderingen die optreden in een chemische reactie. Chemische reacties beginnen met de basiselementen, of al gecombineerde elementen, reactanten genoemd. Het combineren van twee of meer reagentia samen resulteert in een enkel product, of verschillende producten.
4 Identificeer veranderingen die optreden in een chemische reactie. Chemische reacties beginnen met de basiselementen, of al gecombineerde elementen, reactanten genoemd. Het combineren van twee of meer reagentia samen resulteert in een enkel product, of verschillende producten.  1 Herken de soorten reacties. Chemische reacties kunnen optreden als gevolg van vele invloeden, naast het eenvoudig combineren van ingrediënten.
1 Herken de soorten reacties. Chemische reacties kunnen optreden als gevolg van vele invloeden, naast het eenvoudig combineren van ingrediënten.  2 Gebruik de verstrekte hulpmiddelen. Je zult de verschillen in elk soort reactie in je klas moeten begrijpen. Gebruik bronnen die door je docent of professor ter beschikking zijn gesteld om de verschillende soorten reacties te begrijpen die in je klas worden behandeld. Wees niet bang om vragen te stellen.
2 Gebruik de verstrekte hulpmiddelen. Je zult de verschillen in elk soort reactie in je klas moeten begrijpen. Gebruik bronnen die door je docent of professor ter beschikking zijn gesteld om de verschillende soorten reacties te begrijpen die in je klas worden behandeld. Wees niet bang om vragen te stellen.  3 Denk logisch na over chemische reacties. Probeer het niet moeilijker te maken dan het al is door verstrikt te raken in de terminologie.De soorten chemische reacties waarover je leert, zijn gewoon iets doen om iets te veranderen.
3 Denk logisch na over chemische reacties. Probeer het niet moeilijker te maken dan het al is door verstrikt te raken in de terminologie.De soorten chemische reacties waarover je leert, zijn gewoon iets doen om iets te veranderen.  1 Leer hoe verbindingen worden genoemd. Chemie heeft zijn eigen regels voor nomenclatuur. De soorten reacties die plaatsvinden met chemische verbindingen, het verlies of de winst van elektronen in hun buitenste schil, en de stabiliteit of instabiliteit van verbindingen maken deel uit van de chemienomenclatuur.
1 Leer hoe verbindingen worden genoemd. Chemie heeft zijn eigen regels voor nomenclatuur. De soorten reacties die plaatsvinden met chemische verbindingen, het verlies of de winst van elektronen in hun buitenste schil, en de stabiliteit of instabiliteit van verbindingen maken deel uit van de chemienomenclatuur.  2 Neem het gedeelte over nomenclatuur serieus. De meeste beginnende chemielessen hebben een gedeelte dat alleen gewijd is aan nomenclatuur. Op sommige scholen betekent het niet halen van het nomenclatuurgedeelte van de klas dat de klas tekortschiet.
2 Neem het gedeelte over nomenclatuur serieus. De meeste beginnende chemielessen hebben een gedeelte dat alleen gewijd is aan nomenclatuur. Op sommige scholen betekent het niet halen van het nomenclatuurgedeelte van de klas dat de klas tekortschiet. 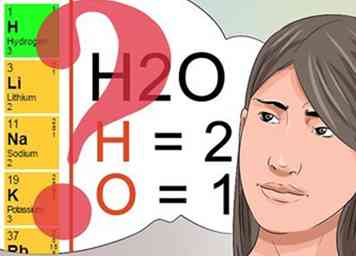 3 Weet wat superscript- en subscriptnummers aangeven. Begrijpen wat superscript- en subscript-cijfers betekenen, is van cruciaal belang voor het behalen van je scheikundeles.[24]
3 Weet wat superscript- en subscriptnummers aangeven. Begrijpen wat superscript- en subscript-cijfers betekenen, is van cruciaal belang voor het behalen van je scheikundeles.[24]  4 Herken hoe atomen met elkaar reageren. Een deel van de nomenclatuur die wordt gebruikt in de chemie omvat specifieke regels voor het benoemen van de producten van specifieke soorten reacties.[25]
4 Herken hoe atomen met elkaar reageren. Een deel van de nomenclatuur die wordt gebruikt in de chemie omvat specifieke regels voor het benoemen van de producten van specifieke soorten reacties.[25]  5 Erken dat subscripts de formule voor een stabiele lading op een verbinding kunnen aangeven. Wetenschappers gebruiken subscripts om de uiteindelijke molecuulformule van een verbinding te identificeren, wat ook een stabiele verbinding met een neutrale lading aangeeft.
5 Erken dat subscripts de formule voor een stabiele lading op een verbinding kunnen aangeven. Wetenschappers gebruiken subscripts om de uiteindelijke molecuulformule van een verbinding te identificeren, wat ook een stabiele verbinding met een neutrale lading aangeeft.  6 Identificeer anionen en kationen van hun positie op het periodiek systeem. De elementen op het periodiek systeem die in de eerste kolom met elementen vallen, worden beschouwd als alkaliën en vormen +1 kationladingen. Bijvoorbeeld Na + en Li +.[30]
6 Identificeer anionen en kationen van hun positie op het periodiek systeem. De elementen op het periodiek systeem die in de eerste kolom met elementen vallen, worden beschouwd als alkaliën en vormen +1 kationladingen. Bijvoorbeeld Na + en Li +.[30]  7 Leer de meer algemene anionen en kationen te herkennen. Om u te helpen uw scheikunde-klasse te doorstaan, moet u zo vertrouwd mogelijk zijn met de nomenclatuur die is gekoppeld aan groepen elementen. Dit type superscript verandert niet.[33]
7 Leer de meer algemene anionen en kationen te herkennen. Om u te helpen uw scheikunde-klasse te doorstaan, moet u zo vertrouwd mogelijk zijn met de nomenclatuur die is gekoppeld aan groepen elementen. Dit type superscript verandert niet.[33]  8 Denk aan scheikunde als het leren van een nieuwe taal. Begrijp dat de geschreven vormen van het aangeven van ladingen, het aantal atomen in een molecuul en de bindingen gevormd om moleculen bij elkaar te houden, allemaal deel uitmaken van de taal van de chemie. Dit alles is een geschreven manier om aan te geven wat er gebeurt in de chemische reacties die niet echt kunnen worden gezien.
8 Denk aan scheikunde als het leren van een nieuwe taal. Begrijp dat de geschreven vormen van het aangeven van ladingen, het aantal atomen in een molecuul en de bindingen gevormd om moleculen bij elkaar te houden, allemaal deel uitmaken van de taal van de chemie. Dit alles is een geschreven manier om aan te geven wat er gebeurt in de chemische reacties die niet echt kunnen worden gezien.  1 Ken de volgorde voor elementaire wiskundige berekeningen. In de chemie zijn soms zeer gedetailleerde berekeningen nodig, maar soms zijn alleen basisvaardigheden voor wiskunde voldoende. Het is belangrijk om de juiste volgorde te begrijpen voor het voltooien van berekeningen in een vergelijking.[35]
1 Ken de volgorde voor elementaire wiskundige berekeningen. In de chemie zijn soms zeer gedetailleerde berekeningen nodig, maar soms zijn alleen basisvaardigheden voor wiskunde voldoende. Het is belangrijk om de juiste volgorde te begrijpen voor het voltooien van berekeningen in een vergelijking.[35]  2 Wees comfortabel en rond heel grote aantallen af. Hoewel het afronden van getallen niet uniek is voor chemie, resulteren de antwoorden op enkele van de complexe wiskundige vergelijkingen in getallen die te lang zijn om te schrijven. Besteed veel aandacht aan de aanwijzingen die worden gegeven bij het afronden van uw antwoorden.[36]
2 Wees comfortabel en rond heel grote aantallen af. Hoewel het afronden van getallen niet uniek is voor chemie, resulteren de antwoorden op enkele van de complexe wiskundige vergelijkingen in getallen die te lang zijn om te schrijven. Besteed veel aandacht aan de aanwijzingen die worden gegeven bij het afronden van uw antwoorden.[36]  3 Begrijp de absolute waarde. In de chemie worden sommige getallen absolute waarde genoemd, en niet hun echte wiskundige waarde. Absolute waarde is de afstand van het getal tot nul.
3 Begrijp de absolute waarde. In de chemie worden sommige getallen absolute waarde genoemd, en niet hun echte wiskundige waarde. Absolute waarde is de afstand van het getal tot nul.  4 Zorg dat u bekend bent met de geaccepteerde maateenheden. Hier zijn een paar voorbeelden.
4 Zorg dat u bekend bent met de geaccepteerde maateenheden. Hier zijn een paar voorbeelden.  5 Oefen het omzetten van de ene schaal naar de andere. Een deel van het slagen voor je scheikunde-les zal het maken van conversies van de ene geaccepteerde schaal naar de andere omvatten. Dit kan het veranderen van de ene temperatuurmeting in de andere omvatten, het veranderen van kilo's in kilogrammen en ons gewicht in liters.
5 Oefen het omzetten van de ene schaal naar de andere. Een deel van het slagen voor je scheikunde-les zal het maken van conversies van de ene geaccepteerde schaal naar de andere omvatten. Dit kan het veranderen van de ene temperatuurmeting in de andere omvatten, het veranderen van kilo's in kilogrammen en ons gewicht in liters.  6 Neem de tijd om te oefenen. Terwijl je wordt blootgesteld aan verschillende conversies in je klas, neem je de tijd om te leren hoe je van de een naar de ander kunt converteren en weer terug.
6 Neem de tijd om te oefenen. Terwijl je wordt blootgesteld aan verschillende conversies in je klas, neem je de tijd om te leren hoe je van de een naar de ander kunt converteren en weer terug.  7 Weet hoe je concentraties moet berekenen. Verbeter je basisvaardigheden in wiskunde op het gebied van percentages, verhoudingen en verhoudingen.
7 Weet hoe je concentraties moet berekenen. Verbeter je basisvaardigheden in wiskunde op het gebied van percentages, verhoudingen en verhoudingen.  8 Oefen met voedingsetiketten op voedingsproducten. Om de chemie te halen, moet je comfortabel zijn bij het berekenen van verhoudingen, verhoudingen, percentages en dan weer terug. Als dit moeilijk voor je is, oefen dan met het gebruik van andere gemeenschappelijke maateenheden, zoals die op voedseletiketten.
8 Oefen met voedingsetiketten op voedingsproducten. Om de chemie te halen, moet je comfortabel zijn bij het berekenen van verhoudingen, verhoudingen, percentages en dan weer terug. Als dit moeilijk voor je is, oefen dan met het gebruik van andere gemeenschappelijke maateenheden, zoals die op voedseletiketten. 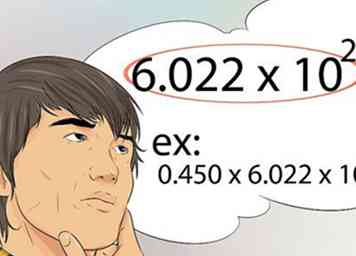 9 Weet hoe u het nummer van Avogadro moet gebruiken. Dit is het getal dat het aantal moleculen, atomen of deeltjes weergeeft, die in één mol worden gevonden. Het nummer van Avogrado is 6.022x10 23.[39]
9 Weet hoe u het nummer van Avogadro moet gebruiken. Dit is het getal dat het aantal moleculen, atomen of deeltjes weergeeft, die in één mol worden gevonden. Het nummer van Avogrado is 6.022x10 23.[39]  10 Denk aan wortels. Als u moeite heeft om te begrijpen hoe u het getal van Avogadro kunt toepassen, denk dan in termen van wortels in plaats van atomen, moleculen of deeltjes. Hoeveel wortels zijn er in een dozijn? Nou, je weet dat een dozijn 12 van iets bevat, dus er zijn 12 wortels in een dozijn.
10 Denk aan wortels. Als u moeite heeft om te begrijpen hoe u het getal van Avogadro kunt toepassen, denk dan in termen van wortels in plaats van atomen, moleculen of deeltjes. Hoeveel wortels zijn er in een dozijn? Nou, je weet dat een dozijn 12 van iets bevat, dus er zijn 12 wortels in een dozijn.  11 Concentreer je op het begrijpen van Molarity. Overweeg het aantal mollen van iets dat zich in een vloeibare omgeving bevindt. Dit voorbeeld is belangrijk om te begrijpen, omdat we het nu over Molarity hebben, of het aandeel van iets uitgedrukt als mollen per liter.
11 Concentreer je op het begrijpen van Molarity. Overweeg het aantal mollen van iets dat zich in een vloeibare omgeving bevindt. Dit voorbeeld is belangrijk om te begrijpen, omdat we het nu over Molarity hebben, of het aandeel van iets uitgedrukt als mollen per liter.  12 Converteer vergelijkingen naar hun empirische formule. Dit betekent dat definitieve antwoorden voor vergelijkingen als verkeerd worden beschouwd, tenzij je ze hebt opgesplitst in hun eenvoudigste vorm.[44]
12 Converteer vergelijkingen naar hun empirische formule. Dit betekent dat definitieve antwoorden voor vergelijkingen als verkeerd worden beschouwd, tenzij je ze hebt opgesplitst in hun eenvoudigste vorm.[44]  13 Weet wat er in een moleculaire formule zit. Je verandert een molecuulformule niet in zijn eenvoudigste of empirische vorm, omdat de molecuulformule je precies vertelt wat het molecuul vormt.
13 Weet wat er in een moleculaire formule zit. Je verandert een molecuulformule niet in zijn eenvoudigste of empirische vorm, omdat de molecuulformule je precies vertelt wat het molecuul vormt.  14 Overweeg chemie wiskunde als stoichiometrie. Je zult deze term waarschijnlijk tegenkomen. Het is een beschrijving van de manier waarop chemie tot uitdrukking wordt gebracht met behulp van wiskundige formules. Met behulp van scheikunde wiskunde, of stoichiometrie, worden waarden van elementen en chemische verbindingen vaak weergegeven in termen van mol, mol%, mol per liter, of mol per kg.[46]
14 Overweeg chemie wiskunde als stoichiometrie. Je zult deze term waarschijnlijk tegenkomen. Het is een beschrijving van de manier waarop chemie tot uitdrukking wordt gebracht met behulp van wiskundige formules. Met behulp van scheikunde wiskunde, of stoichiometrie, worden waarden van elementen en chemische verbindingen vaak weergegeven in termen van mol, mol%, mol per liter, of mol per kg.[46]  15 Vraag om aanvullende voorbeelden. Als de wiskundige vergelijkingen en conversies niet gemakkelijk voor je zijn, praat dan met je docent of professor. Vraag om meer problemen die je alleen kunt oplossen, tot de betrokken concepten en alle factoren van conversie voor jou logisch zijn.
15 Vraag om aanvullende voorbeelden. Als de wiskundige vergelijkingen en conversies niet gemakkelijk voor je zijn, praat dan met je docent of professor. Vraag om meer problemen die je alleen kunt oplossen, tot de betrokken concepten en alle factoren van conversie voor jou logisch zijn.  1 Vorm of word lid van een studiegroep. Schaam je niet als chemie moeilijk voor je is. Het is een moeilijk onderwerp voor bijna iedereen.
1 Vorm of word lid van een studiegroep. Schaam je niet als chemie moeilijk voor je is. Het is een moeilijk onderwerp voor bijna iedereen.  2 Lees alle hoofdstukken in je chemieboek. Het lezen van een scheikundeboek is niet altijd het meest interessante boek op de plank. Maar neem de tijd om de toegewezen secties te lezen en markeer de delen die gewoon niet logisch lijken. Probeer een lijst met vragen of concepten te maken die u moeilijk begrijpt.
2 Lees alle hoofdstukken in je chemieboek. Het lezen van een scheikundeboek is niet altijd het meest interessante boek op de plank. Maar neem de tijd om de toegewezen secties te lezen en markeer de delen die gewoon niet logisch lijken. Probeer een lijst met vragen of concepten te maken die u moeilijk begrijpt.  3 Vraag toestemming om de lezingen op te nemen. Aantekeningen maken en alles bekijken wat de leraar op planken of overhead schrijft, is moeilijk om te doen, vooral in een moeilijk onderwerp als scheikunde. Als u een opname hebt die u steeds opnieuw kunt beluisteren, kunt u het gemakkelijker voor u maken om het te begrijpen. U moet echter altijd toestemming vragen om de colleges op te nemen voordat u dit doet.
3 Vraag toestemming om de lezingen op te nemen. Aantekeningen maken en alles bekijken wat de leraar op planken of overhead schrijft, is moeilijk om te doen, vooral in een moeilijk onderwerp als scheikunde. Als u een opname hebt die u steeds opnieuw kunt beluisteren, kunt u het gemakkelijker voor u maken om het te begrijpen. U moet echter altijd toestemming vragen om de colleges op te nemen voordat u dit doet.  4 Toegang tot oude tests of studiegidsen. De meeste natuurwetenschappelijke cursussen, zoals scheikunde, bieden toegang tot eerdere testvragen om studenten te helpen zich voor te bereiden op grote tests.
4 Toegang tot oude tests of studiegidsen. De meeste natuurwetenschappelijke cursussen, zoals scheikunde, bieden toegang tot eerdere testvragen om studenten te helpen zich voor te bereiden op grote tests.  1 Maak kennis met je professor of leraar. Om de chemie met het best mogelijke cijfer te halen, neem je de tijd om de persoon te ontmoeten die de les geeft. Als je het moeilijk hebt, laat hen dan weten dat dit moeilijk voor je is. Maar zelfs als het goed met je gaat, is het een goed idee om de professor te leren kennen.
1 Maak kennis met je professor of leraar. Om de chemie met het best mogelijke cijfer te halen, neem je de tijd om de persoon te ontmoeten die de les geeft. Als je het moeilijk hebt, laat hen dan weten dat dit moeilijk voor je is. Maar zelfs als het goed met je gaat, is het een goed idee om de professor te leren kennen.  2 Bezoek onlinehulpbronnen. Besteed aandacht aan online bronnen of links die worden aangeboden door de afdeling scheikunde van uw eigen school.
2 Bezoek onlinehulpbronnen. Besteed aandacht aan online bronnen of links die worden aangeboden door de afdeling scheikunde van uw eigen school.  3 Probeer niet overweldigd te raken. De gedetailleerde informatie over de verschillende soorten chemische reacties, het delen van elektronen, het veranderen van de lading van een element of een samenstelling en het weten wat de verschillende soorten reacties doen, kan zeer verwarrend zijn.
3 Probeer niet overweldigd te raken. De gedetailleerde informatie over de verschillende soorten chemische reacties, het delen van elektronen, het veranderen van de lading van een element of een samenstelling en het weten wat de verschillende soorten reacties doen, kan zeer verwarrend zijn.