Het vinden van het aantal protonen, neutronen en elektronen in een bepaald element is niet zo moeilijk als het klinkt. Vaak zit een deel van je antwoord vlak voor je in het periodiek systeem! Als je eenmaal weet waar je moet kijken, is het vinden van het aantal protonen, neutronen en elektronen een koud kunstje.
Deel een van de twee:
Berekenen van protonen, elektronen en neutronen
-
 1 Krijg een periodiek systeem van elementen. Het periodiek systeem is een diagram dat elementen organiseert op basis van hun atomaire structuur. Het heeft een kleurcode en kent elk element een unieke afkorting van 1 of 2 letters toe. Andere elementaire informatie omvat atoomgewicht en atoomnummer.[1]
1 Krijg een periodiek systeem van elementen. Het periodiek systeem is een diagram dat elementen organiseert op basis van hun atomaire structuur. Het heeft een kleurcode en kent elk element een unieke afkorting van 1 of 2 letters toe. Andere elementaire informatie omvat atoomgewicht en atoomnummer.[1] - Je kunt een periodiek systeem online vinden of in een scheikundeboek.
- In tests zal normaal gesproken een periodiek systeem worden verstrekt.
-
 2 Zoek uw element op het periodiek systeem. De tabel bestelt elementen op atoomnummer en scheidt ze in drie hoofdgroepen: metalen, niet-metalen en metalloïden (halfmetalen). Verdere elementaire groepen omvatten alkalimetalen, halogenen en edelgassen.[2]
2 Zoek uw element op het periodiek systeem. De tabel bestelt elementen op atoomnummer en scheidt ze in drie hoofdgroepen: metalen, niet-metalen en metalloïden (halfmetalen). Verdere elementaire groepen omvatten alkalimetalen, halogenen en edelgassen.[2] - Als u de groep (kolommen) of periode (rijen) gebruikt, kan het element gemakkelijker in de tabel worden gevonden.
- U kunt ook in de tabel zoeken naar het symbool van het element als u geen andere eigenschappen kent.
-
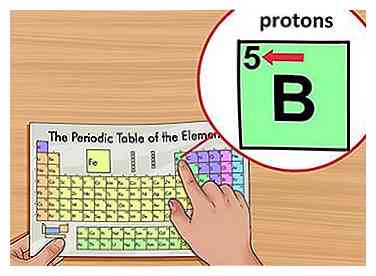 3 Zoek het atoomnummer van het element. Het atoomnummer bevindt zich boven het elementsymbool, in de linkerbovenhoek van het vierkant. Het atoomnummer zal je vertellen hoeveel protonen een enkel atoom van een element vormen.[3]
3 Zoek het atoomnummer van het element. Het atoomnummer bevindt zich boven het elementsymbool, in de linkerbovenhoek van het vierkant. Het atoomnummer zal je vertellen hoeveel protonen een enkel atoom van een element vormen.[3] - Borium (B) heeft bijvoorbeeld een atoomnummer van 5 en daarom heeft het 5 protonen.
-
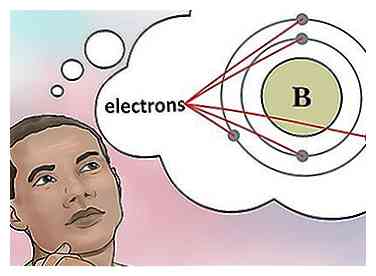 4 Bepaal het aantal elektronen. Protonen zijn deeltjes in de kern van een atoom die een positieve lading hebben die gelijk is aan +1. Elektronen zijn deeltjes met een negatieve lading gelijk aan -1. Daarom zal een element in een neutrale toestand hetzelfde aantal protonen en elektronen hebben.
4 Bepaal het aantal elektronen. Protonen zijn deeltjes in de kern van een atoom die een positieve lading hebben die gelijk is aan +1. Elektronen zijn deeltjes met een negatieve lading gelijk aan -1. Daarom zal een element in een neutrale toestand hetzelfde aantal protonen en elektronen hebben. - Borium (B) heeft bijvoorbeeld een atoomnummer van 5 en daarom heeft het 5 protonen en 5 elektronen.
- Als het element echter een negatief of positief ion bevat, zullen de protonen en elektronen niet hetzelfde zijn. Je moet ze berekenen. Het ionnummer verschijnt als een klein superscript achter het element.
-
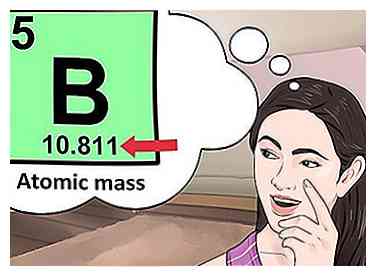 5 Zoek naar de atomaire massa van het element. Om het aantal neutronen te vinden, moet je eerst de atoommassa vinden. De atomaire massa van een element (ook bekend als het atoomgewicht) is de gewogen gemiddelde massa van atomen van een element.[4] De atoommassa bevindt zich onder het symbool voor het element.
5 Zoek naar de atomaire massa van het element. Om het aantal neutronen te vinden, moet je eerst de atoommassa vinden. De atomaire massa van een element (ook bekend als het atoomgewicht) is de gewogen gemiddelde massa van atomen van een element.[4] De atoommassa bevindt zich onder het symbool voor het element. - Zorg ervoor dat je de atomaire massa rond het dichtstbijzijnde hele getal rondt. Bijvoorbeeld, de atomaire massa van boor is 10.811, maar je kunt net de atomaire massa tot 11 rond maken.
-
 6 Trek het atoomnummer van de atoommassa af. Om het aantal neutronen te vinden, moet u het atoomnummer van de atoommassa aftrekken. Onthoud dat het atoomnummer hetzelfde is als het aantal protonen dat u al hebt geïdentificeerd.[5]
6 Trek het atoomnummer van de atoommassa af. Om het aantal neutronen te vinden, moet u het atoomnummer van de atoommassa aftrekken. Onthoud dat het atoomnummer hetzelfde is als het aantal protonen dat u al hebt geïdentificeerd.[5] - Voor ons boorvoorbeeld, 11 (atomaire massa) - 5 (atoomnummer) = 6 neutronen
Deel twee van twee:
Berekening van de elektronen met aanwezige ionen
-
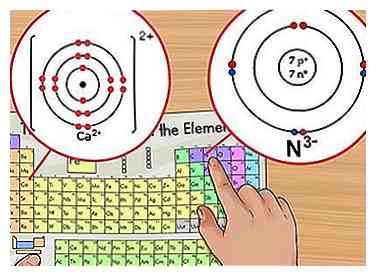 1 Identificeer de netto lading. De netto lading van een ion verschijnt als een klein superscriptnummer dat het element volgt. Een ion is een atoom dat een positieve of negatieve lading heeft vanwege de toevoeging of verwijdering van elektronen.[6] Hoewel het aantal protonen in het atoom hetzelfde blijft, is het aantal elektronen veranderd in een ion.
1 Identificeer de netto lading. De netto lading van een ion verschijnt als een klein superscriptnummer dat het element volgt. Een ion is een atoom dat een positieve of negatieve lading heeft vanwege de toevoeging of verwijdering van elektronen.[6] Hoewel het aantal protonen in het atoom hetzelfde blijft, is het aantal elektronen veranderd in een ion. - Omdat een elektron een negatieve lading heeft, wordt het ion positief wanneer je elektronen verwijdert. Wanneer u meer elektronen toevoegt, wordt het ion negatief.
- Bijvoorbeeld N3- heeft een -3 lading terwijl Ca2+ heeft een +2 lading.
- Houd er rekening mee dat u deze berekening niet hoeft uit te voeren als er geen superscript-ionnummer achter het element staat.
-
 2 Trek de lading van het atoomnummer af. Wanneer een ion een positieve lading heeft, heeft het atoom elektronen verloren. Om het resterende aantal elektronen te berekenen, trekt u de hoeveelheid extra lading van het atoomnummer af. In het geval van een positief ion zijn er meer protonen dan elektronen.
2 Trek de lading van het atoomnummer af. Wanneer een ion een positieve lading heeft, heeft het atoom elektronen verloren. Om het resterende aantal elektronen te berekenen, trekt u de hoeveelheid extra lading van het atoomnummer af. In het geval van een positief ion zijn er meer protonen dan elektronen. - Bijvoorbeeld Ca2+ heeft een +2 lading, dus het heeft 2 elektronen verloren vanuit de neutrale toestand. Het atoomnummer van calcium is 20, daarom heeft het ion 18 elektronen.
-
 3 Voeg de lading toe aan het atoomnummer voor negatieve ionen. Wanneer een ion een negatieve lading heeft, heeft het atoom elektronen gewonnen. Om het totale aantal aanwezige elektronen te berekenen, voegt u gewoon de hoeveelheid extra lading toe aan het atoomnummer. In het geval van een negatief ion zijn er minder protonen dan elektronen.
3 Voeg de lading toe aan het atoomnummer voor negatieve ionen. Wanneer een ion een negatieve lading heeft, heeft het atoom elektronen gewonnen. Om het totale aantal aanwezige elektronen te berekenen, voegt u gewoon de hoeveelheid extra lading toe aan het atoomnummer. In het geval van een negatief ion zijn er minder protonen dan elektronen. - Bijvoorbeeld N3- heeft een -3 lading; daarom heeft het 3 elektronen gewonnen ten opzichte van de neutrale toestand. Het atoomnummer van stikstof is 7, daarom heeft dit ion 10 elektronen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Krijg een periodiek systeem van elementen. Het periodiek systeem is een diagram dat elementen organiseert op basis van hun atomaire structuur. Het heeft een kleurcode en kent elk element een unieke afkorting van 1 of 2 letters toe. Andere elementaire informatie omvat atoomgewicht en atoomnummer.[1]
1 Krijg een periodiek systeem van elementen. Het periodiek systeem is een diagram dat elementen organiseert op basis van hun atomaire structuur. Het heeft een kleurcode en kent elk element een unieke afkorting van 1 of 2 letters toe. Andere elementaire informatie omvat atoomgewicht en atoomnummer.[1]  2 Zoek uw element op het periodiek systeem. De tabel bestelt elementen op atoomnummer en scheidt ze in drie hoofdgroepen: metalen, niet-metalen en metalloïden (halfmetalen). Verdere elementaire groepen omvatten alkalimetalen, halogenen en edelgassen.[2]
2 Zoek uw element op het periodiek systeem. De tabel bestelt elementen op atoomnummer en scheidt ze in drie hoofdgroepen: metalen, niet-metalen en metalloïden (halfmetalen). Verdere elementaire groepen omvatten alkalimetalen, halogenen en edelgassen.[2]  3 Zoek het atoomnummer van het element. Het atoomnummer bevindt zich boven het elementsymbool, in de linkerbovenhoek van het vierkant. Het atoomnummer zal je vertellen hoeveel protonen een enkel atoom van een element vormen.[3]
3 Zoek het atoomnummer van het element. Het atoomnummer bevindt zich boven het elementsymbool, in de linkerbovenhoek van het vierkant. Het atoomnummer zal je vertellen hoeveel protonen een enkel atoom van een element vormen.[3]  4 Bepaal het aantal elektronen. Protonen zijn deeltjes in de kern van een atoom die een positieve lading hebben die gelijk is aan +1. Elektronen zijn deeltjes met een negatieve lading gelijk aan -1. Daarom zal een element in een neutrale toestand hetzelfde aantal protonen en elektronen hebben.
4 Bepaal het aantal elektronen. Protonen zijn deeltjes in de kern van een atoom die een positieve lading hebben die gelijk is aan +1. Elektronen zijn deeltjes met een negatieve lading gelijk aan -1. Daarom zal een element in een neutrale toestand hetzelfde aantal protonen en elektronen hebben. 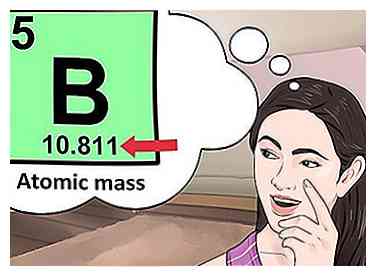 5 Zoek naar de atomaire massa van het element. Om het aantal neutronen te vinden, moet je eerst de atoommassa vinden. De atomaire massa van een element (ook bekend als het atoomgewicht) is de gewogen gemiddelde massa van atomen van een element.[4] De atoommassa bevindt zich onder het symbool voor het element.
5 Zoek naar de atomaire massa van het element. Om het aantal neutronen te vinden, moet je eerst de atoommassa vinden. De atomaire massa van een element (ook bekend als het atoomgewicht) is de gewogen gemiddelde massa van atomen van een element.[4] De atoommassa bevindt zich onder het symbool voor het element.  6 Trek het atoomnummer van de atoommassa af. Om het aantal neutronen te vinden, moet u het atoomnummer van de atoommassa aftrekken. Onthoud dat het atoomnummer hetzelfde is als het aantal protonen dat u al hebt geïdentificeerd.[5]
6 Trek het atoomnummer van de atoommassa af. Om het aantal neutronen te vinden, moet u het atoomnummer van de atoommassa aftrekken. Onthoud dat het atoomnummer hetzelfde is als het aantal protonen dat u al hebt geïdentificeerd.[5]  1 Identificeer de netto lading. De netto lading van een ion verschijnt als een klein superscriptnummer dat het element volgt. Een ion is een atoom dat een positieve of negatieve lading heeft vanwege de toevoeging of verwijdering van elektronen.[6] Hoewel het aantal protonen in het atoom hetzelfde blijft, is het aantal elektronen veranderd in een ion.
1 Identificeer de netto lading. De netto lading van een ion verschijnt als een klein superscriptnummer dat het element volgt. Een ion is een atoom dat een positieve of negatieve lading heeft vanwege de toevoeging of verwijdering van elektronen.[6] Hoewel het aantal protonen in het atoom hetzelfde blijft, is het aantal elektronen veranderd in een ion.  2 Trek de lading van het atoomnummer af. Wanneer een ion een positieve lading heeft, heeft het atoom elektronen verloren. Om het resterende aantal elektronen te berekenen, trekt u de hoeveelheid extra lading van het atoomnummer af. In het geval van een positief ion zijn er meer protonen dan elektronen.
2 Trek de lading van het atoomnummer af. Wanneer een ion een positieve lading heeft, heeft het atoom elektronen verloren. Om het resterende aantal elektronen te berekenen, trekt u de hoeveelheid extra lading van het atoomnummer af. In het geval van een positief ion zijn er meer protonen dan elektronen.  3 Voeg de lading toe aan het atoomnummer voor negatieve ionen. Wanneer een ion een negatieve lading heeft, heeft het atoom elektronen gewonnen. Om het totale aantal aanwezige elektronen te berekenen, voegt u gewoon de hoeveelheid extra lading toe aan het atoomnummer. In het geval van een negatief ion zijn er minder protonen dan elektronen.
3 Voeg de lading toe aan het atoomnummer voor negatieve ionen. Wanneer een ion een negatieve lading heeft, heeft het atoom elektronen gewonnen. Om het totale aantal aanwezige elektronen te berekenen, voegt u gewoon de hoeveelheid extra lading toe aan het atoomnummer. In het geval van een negatief ion zijn er minder protonen dan elektronen.