Hoewel alle atomen van hetzelfde element hetzelfde aantal protonen bevatten, kan hun aantal neutronen variëren. Als je weet hoeveel neutronen er in een bepaald atoom zitten, kun je bepalen of het een gewoon atoom van dat element is of een isotoop, met ofwel extra of minder neutronen.[1] Het bepalen van het aantal neutronen in een atoom is vrij eenvoudig en vereist zelfs geen experimenten. Om het aantal neutronen in een normaal atoom of een isotoop te berekenen, volstaat het om deze instructies te volgen met een periodiek systeem in de hand.
Methode één van de twee:
Het aantal neutronen vinden in een regulier atoom
-
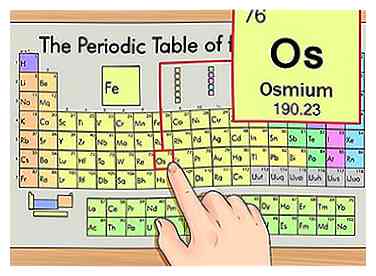 1 Zoek het element op het periodiek systeem. Voor dit voorbeeld kijken we naar osmium (Os), dat zich in de zesde rij bevindt.
1 Zoek het element op het periodiek systeem. Voor dit voorbeeld kijken we naar osmium (Os), dat zich in de zesde rij bevindt. -
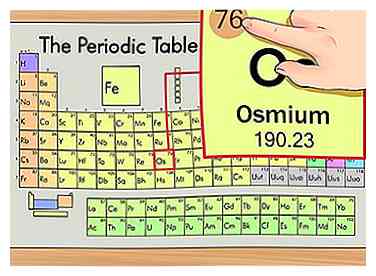 2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool, in het midden van de doos of in de linkerbovenhoek. (In de grafiek die we gebruiken, zijn er feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. Os is nummer 76, wat betekent dat één osmiumatoom 76 protonen heeft.
2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool, in het midden van de doos of in de linkerbovenhoek. (In de grafiek die we gebruiken, zijn er feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. Os is nummer 76, wat betekent dat één osmiumatoom 76 protonen heeft. - Het protonnummer verandert nooit in een element; het is in feite wat dat element dat element maakt.
-
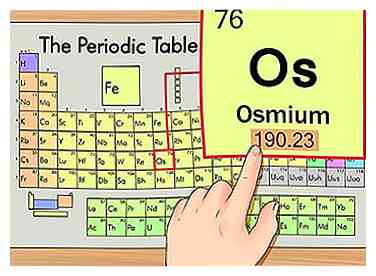 3 Zoek het atomaire gewicht van het element. Dit nummer bevindt zich meestal onder het atoomsymbool. Merk op dat de grafiek in dit voorbeeld alleen gebaseerd is op het atoomnummer en niet het atomaire gewicht. Dit zal niet altijd het geval zijn. Osmium heeft een atoomgewicht van 190.23.
3 Zoek het atomaire gewicht van het element. Dit nummer bevindt zich meestal onder het atoomsymbool. Merk op dat de grafiek in dit voorbeeld alleen gebaseerd is op het atoomnummer en niet het atomaire gewicht. Dit zal niet altijd het geval zijn. Osmium heeft een atoomgewicht van 190.23. -
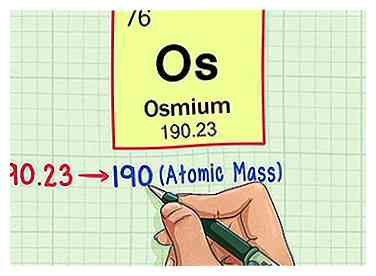 4 Rond het atoomgewicht af op het dichtstbijzijnde hele getal om de atoommassa te vinden. In ons voorbeeld zou 190.23 worden afgerond op 190, wat resulteert in een atomaire massa van 190 voor osmium.
4 Rond het atoomgewicht af op het dichtstbijzijnde hele getal om de atoommassa te vinden. In ons voorbeeld zou 190.23 worden afgerond op 190, wat resulteert in een atomaire massa van 190 voor osmium. - Het atoomgewicht is een gemiddelde van de isotopen van het element, dus daarom is het meestal geen geheel getal.
-
 5 Trek het atoomnummer van de atoommassa af. Omdat de overgrote meerderheid van de massa van een atoom bestaat uit zijn protonen en neutronen, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. De cijfers achter de komma vertegenwoordigen de doorgaans zeer kleine massa van de elektronen in het atoom. In ons voorbeeld is dit: 190 (atoomgewicht) - 76 (aantal protonen) = 114 (aantal neutronen).
5 Trek het atoomnummer van de atoommassa af. Omdat de overgrote meerderheid van de massa van een atoom bestaat uit zijn protonen en neutronen, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. De cijfers achter de komma vertegenwoordigen de doorgaans zeer kleine massa van de elektronen in het atoom. In ons voorbeeld is dit: 190 (atoomgewicht) - 76 (aantal protonen) = 114 (aantal neutronen). -
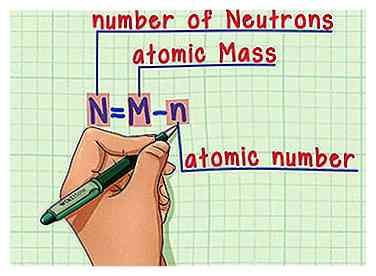 6 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule:
6 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule: - N = M - n
- N = aantal Neutrons
- M = atomisch Mezel
- n = atomisch nomber
- N = M - n
Methode twee van twee:
Het aantal neutronen in een isotoop vinden
-
 1 Zoek het element op het periodiek systeem. We zullen bijvoorbeeld de koolstof-14-isotoop bekijken. Omdat de niet-isotoop-vorm van koolstof-14 eenvoudigweg koolstof (C) is, vindt u koolstof op het periodiek systeem (in de tweede rij lager).
1 Zoek het element op het periodiek systeem. We zullen bijvoorbeeld de koolstof-14-isotoop bekijken. Omdat de niet-isotoop-vorm van koolstof-14 eenvoudigweg koolstof (C) is, vindt u koolstof op het periodiek systeem (in de tweede rij lager). -
 2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool. (Op onze voorbeeldtabel staan feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. C is nummer 6, wat betekent dat één koolstofatoom zes protonen heeft.
2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool. (Op onze voorbeeldtabel staan feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. C is nummer 6, wat betekent dat één koolstofatoom zes protonen heeft. -
 3 Zoek de atoommassa. Dit is ongelooflijk gemakkelijk met isotopen, omdat ze worden genoemd naar hun atoommassa. Koolstof-14, bijvoorbeeld, heeft een atomaire massa van 14. Zodra je de atomaire massa van de isotoop hebt gevonden, is het proces hetzelfde als voor het vinden van het aantal neutronen in een normaal atoom.
3 Zoek de atoommassa. Dit is ongelooflijk gemakkelijk met isotopen, omdat ze worden genoemd naar hun atoommassa. Koolstof-14, bijvoorbeeld, heeft een atomaire massa van 14. Zodra je de atomaire massa van de isotoop hebt gevonden, is het proces hetzelfde als voor het vinden van het aantal neutronen in een normaal atoom. -
 4 Trek het atoomnummer van de atoommassa af. Aangezien de overgrote meerderheid van de massa van een atoom zijn protonen en neutronen vindt, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. In ons voorbeeld is dit: 14 (atomaire massa) - 6 (aantal protonen) = 8 (aantal neutronen).
4 Trek het atoomnummer van de atoommassa af. Aangezien de overgrote meerderheid van de massa van een atoom zijn protonen en neutronen vindt, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. In ons voorbeeld is dit: 14 (atomaire massa) - 6 (aantal protonen) = 8 (aantal neutronen). -
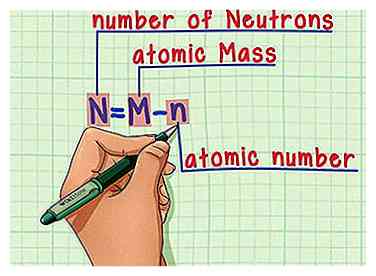 5 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule:
5 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule: - N = M - n
- N = aantal Neutrons
- M = atomisch Mezel
- n = atomisch nomber
- N = M - n
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Zoek het element op het periodiek systeem. Voor dit voorbeeld kijken we naar osmium (Os), dat zich in de zesde rij bevindt.
1 Zoek het element op het periodiek systeem. Voor dit voorbeeld kijken we naar osmium (Os), dat zich in de zesde rij bevindt.  2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool, in het midden van de doos of in de linkerbovenhoek. (In de grafiek die we gebruiken, zijn er feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. Os is nummer 76, wat betekent dat één osmiumatoom 76 protonen heeft.
2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool, in het midden van de doos of in de linkerbovenhoek. (In de grafiek die we gebruiken, zijn er feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. Os is nummer 76, wat betekent dat één osmiumatoom 76 protonen heeft.  3 Zoek het atomaire gewicht van het element. Dit nummer bevindt zich meestal onder het atoomsymbool. Merk op dat de grafiek in dit voorbeeld alleen gebaseerd is op het atoomnummer en niet het atomaire gewicht. Dit zal niet altijd het geval zijn. Osmium heeft een atoomgewicht van 190.23.
3 Zoek het atomaire gewicht van het element. Dit nummer bevindt zich meestal onder het atoomsymbool. Merk op dat de grafiek in dit voorbeeld alleen gebaseerd is op het atoomnummer en niet het atomaire gewicht. Dit zal niet altijd het geval zijn. Osmium heeft een atoomgewicht van 190.23.  4 Rond het atoomgewicht af op het dichtstbijzijnde hele getal om de atoommassa te vinden. In ons voorbeeld zou 190.23 worden afgerond op 190, wat resulteert in een atomaire massa van 190 voor osmium.
4 Rond het atoomgewicht af op het dichtstbijzijnde hele getal om de atoommassa te vinden. In ons voorbeeld zou 190.23 worden afgerond op 190, wat resulteert in een atomaire massa van 190 voor osmium.  5 Trek het atoomnummer van de atoommassa af. Omdat de overgrote meerderheid van de massa van een atoom bestaat uit zijn protonen en neutronen, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. De cijfers achter de komma vertegenwoordigen de doorgaans zeer kleine massa van de elektronen in het atoom. In ons voorbeeld is dit: 190 (atoomgewicht) - 76 (aantal protonen) = 114 (aantal neutronen).
5 Trek het atoomnummer van de atoommassa af. Omdat de overgrote meerderheid van de massa van een atoom bestaat uit zijn protonen en neutronen, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. De cijfers achter de komma vertegenwoordigen de doorgaans zeer kleine massa van de elektronen in het atoom. In ons voorbeeld is dit: 190 (atoomgewicht) - 76 (aantal protonen) = 114 (aantal neutronen).  6 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule:
6 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule:  1 Zoek het element op het periodiek systeem. We zullen bijvoorbeeld de koolstof-14-isotoop bekijken. Omdat de niet-isotoop-vorm van koolstof-14 eenvoudigweg koolstof (C) is, vindt u koolstof op het periodiek systeem (in de tweede rij lager).
1 Zoek het element op het periodiek systeem. We zullen bijvoorbeeld de koolstof-14-isotoop bekijken. Omdat de niet-isotoop-vorm van koolstof-14 eenvoudigweg koolstof (C) is, vindt u koolstof op het periodiek systeem (in de tweede rij lager).  2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool. (Op onze voorbeeldtabel staan feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. C is nummer 6, wat betekent dat één koolstofatoom zes protonen heeft.
2 Zoek het atoomnummer van het element. Dit is meestal het meest zichtbare nummer dat bij een bepaald element hoort en zit meestal boven het elementsymbool. (Op onze voorbeeldtabel staan feitelijk geen andere nummers vermeld.) Het atoomnummer is het aantal protonen in een enkel atoom van dat element. C is nummer 6, wat betekent dat één koolstofatoom zes protonen heeft.  3 Zoek de atoommassa. Dit is ongelooflijk gemakkelijk met isotopen, omdat ze worden genoemd naar hun atoommassa. Koolstof-14, bijvoorbeeld, heeft een atomaire massa van 14. Zodra je de atomaire massa van de isotoop hebt gevonden, is het proces hetzelfde als voor het vinden van het aantal neutronen in een normaal atoom.
3 Zoek de atoommassa. Dit is ongelooflijk gemakkelijk met isotopen, omdat ze worden genoemd naar hun atoommassa. Koolstof-14, bijvoorbeeld, heeft een atomaire massa van 14. Zodra je de atomaire massa van de isotoop hebt gevonden, is het proces hetzelfde als voor het vinden van het aantal neutronen in een normaal atoom.  4 Trek het atoomnummer van de atoommassa af. Aangezien de overgrote meerderheid van de massa van een atoom zijn protonen en neutronen vindt, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. In ons voorbeeld is dit: 14 (atomaire massa) - 6 (aantal protonen) = 8 (aantal neutronen).
4 Trek het atoomnummer van de atoommassa af. Aangezien de overgrote meerderheid van de massa van een atoom zijn protonen en neutronen vindt, zal het aftrekken van het aantal protonen (dat wil zeggen het atoomnummer) van de atoommassa je de berekend aantal neutronen in het atoom. In ons voorbeeld is dit: 14 (atomaire massa) - 6 (aantal protonen) = 8 (aantal neutronen).  5 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule:
5 Onthoud de formule. Om het aantal neutronen in de toekomst te vinden, gebruikt u gewoon deze formule: