Als je huiswerk hebt gekregen waarbij je de empirische formule van een compound moet vinden, maar je hebt geen idee hoe je moet beginnen, wees nooit bang! wikiHow is hier om te helpen! Bekijk eerst de basiskennis die je nodig hebt om de empirische formule te vinden en loop vervolgens een voorbeeld door in deel 2.
Methode één van de twee:
De basisprincipes begrijpen
-
 1 Weet wat de empirische formule is. In de chemie is de EF de eenvoudigste manier om een samenstelling te beschrijven - het is in feite een lijst van de elementen waaruit een verbinding bestaat, gerangschikt naar percentage. Het is belangrijk op te merken dat deze eenvoudige formule de. Niet beschrijft arrangement van de atomen in de verbinding, het geeft eenvoudig aan van welke elementen de verbinding is gemaakt. Bijvoorbeeld:
1 Weet wat de empirische formule is. In de chemie is de EF de eenvoudigste manier om een samenstelling te beschrijven - het is in feite een lijst van de elementen waaruit een verbinding bestaat, gerangschikt naar percentage. Het is belangrijk op te merken dat deze eenvoudige formule de. Niet beschrijft arrangement van de atomen in de verbinding, het geeft eenvoudig aan van welke elementen de verbinding is gemaakt. Bijvoorbeeld: - Een verbinding die bestaat uit 40,92% koolstof, 4,58% waterstof en 54,5% zuurstof heeft een empirische formule van C3H4O3 (we zullen een voorbeeld bekijken van hoe we de EF van deze verbinding kunnen vinden in deel twee).
-
 2 Begrijp de term 'percentagesamenstelling'. 'Percentiesamenstelling' verwijst naar het percentage van elk afzonderlijk atoom in de hele samenstelling waarnaar we kijken. Om de empirische formule van een verbinding te vinden, moeten we de percentagesamenstelling van de verbinding kennen. Als u de empirische formule voor huiswerk vindt, krijgt u waarschijnlijk de percentages.
2 Begrijp de term 'percentagesamenstelling'. 'Percentiesamenstelling' verwijst naar het percentage van elk afzonderlijk atoom in de hele samenstelling waarnaar we kijken. Om de empirische formule van een verbinding te vinden, moeten we de percentagesamenstelling van de verbinding kennen. Als u de empirische formule voor huiswerk vindt, krijgt u waarschijnlijk de percentages. - In een chemisch laboratorium, om de percentagesamenstelling te vinden, zou de samenstelling door sommige fysieke experimenten en dan kwantitatieve analyse worden onderzocht. Tenzij je in een lab bent, hoef je deze experimenten niet echt te doen.
-
 3 Wees je ervan bewust dat je te maken hebt met gram-atomen. Een gramatoom is de specifieke hoeveelheid van een element waarvan het gewicht in gram gelijk is aan de atomaire massa. Om een gramatoom te vinden, is de vergelijking: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element.[1]
3 Wees je ervan bewust dat je te maken hebt met gram-atomen. Een gramatoom is de specifieke hoeveelheid van een element waarvan het gewicht in gram gelijk is aan de atomaire massa. Om een gramatoom te vinden, is de vergelijking: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element.[1] - Laten we zeggen dat we een verbinding hebben die bestaat uit 40,92% koolstof. De atomaire massa van koolstof is 12, dus onze vergelijking zou 40.92 / 12 = 3.41 zijn.
-
 4 Weet hoe je de atomaire ratio kunt vinden. Als u met een compound werkt, heeft u meer dan één gramatoom om te berekenen. Nadat je alle gram-atomen in je compound hebt gevonden, kijk je ze allemaal na. Om de atomaire ratio te vinden, moet je het gramatoom kiezen dat het kleinst is van alle gram-atomen die je hebt berekend. Je deelt dan al je gram-atomen door het kleinste gramatoom. Bijvoorbeeld:
4 Weet hoe je de atomaire ratio kunt vinden. Als u met een compound werkt, heeft u meer dan één gramatoom om te berekenen. Nadat je alle gram-atomen in je compound hebt gevonden, kijk je ze allemaal na. Om de atomaire ratio te vinden, moet je het gramatoom kiezen dat het kleinst is van alle gram-atomen die je hebt berekend. Je deelt dan al je gram-atomen door het kleinste gramatoom. Bijvoorbeeld: - Laten we zeggen dat we werken met een verbinding met drie gram-atomen: 1,5, 2 en 2,5. Het kleinste gramatoom uit deze drie getallen is 1,5. Dus om de atomaire verhouding te vinden, moet je alle getallen met 1,5 delen en ze vervolgens scheiden met het symbool voor de verhouding :.
- 1.5 / 1.5 = 1. 2 / 1.5 = 1.33. 2,5 / 1,5 = 1,66. Dus je atoomverhouding is 1 : 1.33 : 1.66.
-
 5 Begrijpen hoe je aantallen atomaire verhoudingen omzet in hele getallen. Bij het schrijven van een empirische formule heb je hele getallen nodig. Dit betekent dat je een nummer zoals 1.33 niet kunt gebruiken. Nadat je je atomaire ratio hebt gevonden, moet je alle deelnummers (opnieuw, zoals 1,33) converteren naar hele getallen (zoals 3). Om dit te doen, moet je een heel getal vinden dat vermenigvuldigd kan worden met elk individueel getal in je atoomverhouding om een heel getal te krijgen. Bijvoorbeeld:
5 Begrijpen hoe je aantallen atomaire verhoudingen omzet in hele getallen. Bij het schrijven van een empirische formule heb je hele getallen nodig. Dit betekent dat je een nummer zoals 1.33 niet kunt gebruiken. Nadat je je atomaire ratio hebt gevonden, moet je alle deelnummers (opnieuw, zoals 1,33) converteren naar hele getallen (zoals 3). Om dit te doen, moet je een heel getal vinden dat vermenigvuldigd kan worden met elk individueel getal in je atoomverhouding om een heel getal te krijgen. Bijvoorbeeld: - Probeer 2. Vermenigvuldig de getallen in je atoomverhouding (1, 1.33 en 1.66) met 2. Je krijgt 2, 2,66 en 3,32. Dit zijn geen hele getallen dus 2 werkt niet.
- Probeer 3. Je krijgt 3, 4 en 5 wanneer je 1, 1.33 en 1.66 op 3 vermenigvuldigt. Daarom is je atoomverhouding van hele getallen 3 : 4 : 5.
-
 6 Begrijp wat die hele getallen betekenen voor de empirische formule. De hele cijferratio die we zojuist hebben opgelost, past eigenlijk in de empirische formule. Die drie hele getallen zijn de kleine cijfers die aan de voet van elke letter hangen die een afzonderlijk element van de verbinding vertegenwoordigt. Onze samengestelde empirische formule zou er bijvoorbeeld als volgt uitzien:
6 Begrijp wat die hele getallen betekenen voor de empirische formule. De hele cijferratio die we zojuist hebben opgelost, past eigenlijk in de empirische formule. Die drie hele getallen zijn de kleine cijfers die aan de voet van elke letter hangen die een afzonderlijk element van de verbinding vertegenwoordigt. Onze samengestelde empirische formule zou er bijvoorbeeld als volgt uitzien: - X3Y4Z5
Methode twee van twee:
De empirische formule vinden
-
 1 Bepaal de percentagesamenstelling van uw verbinding. Als u de empirische formule voor een huiswerkopdracht probeert te vinden, krijgt u hoogstwaarschijnlijk de percentagesamenstelling; u hoeft alleen maar te weten waar u moet zoeken. Bijvoorbeeld:
1 Bepaal de percentagesamenstelling van uw verbinding. Als u de empirische formule voor een huiswerkopdracht probeert te vinden, krijgt u hoogstwaarschijnlijk de percentagesamenstelling; u hoeft alleen maar te weten waar u moet zoeken. Bijvoorbeeld: - Laten we zeggen dat de opdracht je vraagt om naar een monster vitamine C te kijken. Het bevat 40,92% koolstof, 4,58% waterstof, 54,5% zuurstof, dit is het percentage samenstelling.
- 40,92% van de vitamine C is gemaakt van koolstof, terwijl de rest bestaat uit 4,58% waterstof en 54,5% zuurstof.
-
 2 Zoek het aantal gram-atomen in de verbinding. Zoals besproken in Deel 1, is de vergelijking voor het vinden van het aantal gram-atomen: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element. Voor ons voorbeeld is de atomaire massa van koolstof 12, waterstof 1 en zuurstof 16.
2 Zoek het aantal gram-atomen in de verbinding. Zoals besproken in Deel 1, is de vergelijking voor het vinden van het aantal gram-atomen: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element. Voor ons voorbeeld is de atomaire massa van koolstof 12, waterstof 1 en zuurstof 16. - Aantal gram-atomen koolstof = 40,92 / 12 = 3,41
- Aantal gram-atomen waterstof = 04.58 / 01 = 4.58
- Aantal gram-atomen zuurstof = 54.50 / 16 = 3.41
-
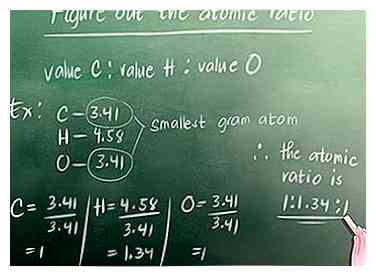 3 Bereken de atoomverhouding. Zoek naar het gram-atoom dat de kleinste is van alle gram-atomen die we net hebben berekend. Voor ons voorbeeld is dit 3,41 (koolstof of zuurstof - ze hebben allebei dezelfde waarde). Vervolgens moet u alle gram-atoomwaarden door dit getal verdelen. Je schrijft de verhouding als volgt: waarde Carbon: waarde Waterstof: waarde Zuurstof.
3 Bereken de atoomverhouding. Zoek naar het gram-atoom dat de kleinste is van alle gram-atomen die we net hebben berekend. Voor ons voorbeeld is dit 3,41 (koolstof of zuurstof - ze hebben allebei dezelfde waarde). Vervolgens moet u alle gram-atoomwaarden door dit getal verdelen. Je schrijft de verhouding als volgt: waarde Carbon: waarde Waterstof: waarde Zuurstof. - Koolstof: 3,41 / 3,41 = 1
- Waterstof: 4,58 / 3,41 = 1,34
- Zuurstof: 3,41 / 3,41 = 1
- De atoomverhouding is 1 : 1.34 : 1.
-
 4 Converteer de verhouding naar hele getallen. Als je atoomverhouding hele getallen heeft, kun je deze stap overslaan. Voor ons voorbeeld moeten we echter 1.34 naar een geheel getal converteren.Ons kleinste hele getal dat vermenigvuldigd kan worden met de getallen in onze atoomverhouding om hele getallen te maken is 3.
4 Converteer de verhouding naar hele getallen. Als je atoomverhouding hele getallen heeft, kun je deze stap overslaan. Voor ons voorbeeld moeten we echter 1.34 naar een geheel getal converteren.Ons kleinste hele getal dat vermenigvuldigd kan worden met de getallen in onze atoomverhouding om hele getallen te maken is 3. - 1 x 3 = 3 (dit werkt omdat 3 een geheel getal is).
- 1,34 x 3 = 4 (4 is ook een geheel getal).
- 1 x 3 = 3 (nogmaals, 3 is een geheel getal).
- Onze hele getalsverhouding is daarom koolstof (C): waterstof (H): zuurstof (O) = 3 : 4 : 3
-
 5 Schrijf de empirische formule op. Om dit te doen, hoef je alleen maar de letters van elke component te schrijven, in dit geval C voor koolstof, H voor waterstof en O voor zuurstof, met hun hele getallenteller als subscript. De empirische formule voor ons voorbeeld is:
5 Schrijf de empirische formule op. Om dit te doen, hoef je alleen maar de letters van elke component te schrijven, in dit geval C voor koolstof, H voor waterstof en O voor zuurstof, met hun hele getallenteller als subscript. De empirische formule voor ons voorbeeld is: - C3H4O3
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Weet wat de empirische formule is. In de chemie is de EF de eenvoudigste manier om een samenstelling te beschrijven - het is in feite een lijst van de elementen waaruit een verbinding bestaat, gerangschikt naar percentage. Het is belangrijk op te merken dat deze eenvoudige formule de. Niet beschrijft arrangement van de atomen in de verbinding, het geeft eenvoudig aan van welke elementen de verbinding is gemaakt. Bijvoorbeeld:
1 Weet wat de empirische formule is. In de chemie is de EF de eenvoudigste manier om een samenstelling te beschrijven - het is in feite een lijst van de elementen waaruit een verbinding bestaat, gerangschikt naar percentage. Het is belangrijk op te merken dat deze eenvoudige formule de. Niet beschrijft arrangement van de atomen in de verbinding, het geeft eenvoudig aan van welke elementen de verbinding is gemaakt. Bijvoorbeeld:  2 Begrijp de term 'percentagesamenstelling'. 'Percentiesamenstelling' verwijst naar het percentage van elk afzonderlijk atoom in de hele samenstelling waarnaar we kijken. Om de empirische formule van een verbinding te vinden, moeten we de percentagesamenstelling van de verbinding kennen. Als u de empirische formule voor huiswerk vindt, krijgt u waarschijnlijk de percentages.
2 Begrijp de term 'percentagesamenstelling'. 'Percentiesamenstelling' verwijst naar het percentage van elk afzonderlijk atoom in de hele samenstelling waarnaar we kijken. Om de empirische formule van een verbinding te vinden, moeten we de percentagesamenstelling van de verbinding kennen. Als u de empirische formule voor huiswerk vindt, krijgt u waarschijnlijk de percentages.  3 Wees je ervan bewust dat je te maken hebt met gram-atomen. Een gramatoom is de specifieke hoeveelheid van een element waarvan het gewicht in gram gelijk is aan de atomaire massa. Om een gramatoom te vinden, is de vergelijking: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element.[1]
3 Wees je ervan bewust dat je te maken hebt met gram-atomen. Een gramatoom is de specifieke hoeveelheid van een element waarvan het gewicht in gram gelijk is aan de atomaire massa. Om een gramatoom te vinden, is de vergelijking: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element.[1]  4 Weet hoe je de atomaire ratio kunt vinden. Als u met een compound werkt, heeft u meer dan één gramatoom om te berekenen. Nadat je alle gram-atomen in je compound hebt gevonden, kijk je ze allemaal na. Om de atomaire ratio te vinden, moet je het gramatoom kiezen dat het kleinst is van alle gram-atomen die je hebt berekend. Je deelt dan al je gram-atomen door het kleinste gramatoom. Bijvoorbeeld:
4 Weet hoe je de atomaire ratio kunt vinden. Als u met een compound werkt, heeft u meer dan één gramatoom om te berekenen. Nadat je alle gram-atomen in je compound hebt gevonden, kijk je ze allemaal na. Om de atomaire ratio te vinden, moet je het gramatoom kiezen dat het kleinst is van alle gram-atomen die je hebt berekend. Je deelt dan al je gram-atomen door het kleinste gramatoom. Bijvoorbeeld:  5 Begrijpen hoe je aantallen atomaire verhoudingen omzet in hele getallen. Bij het schrijven van een empirische formule heb je hele getallen nodig. Dit betekent dat je een nummer zoals 1.33 niet kunt gebruiken. Nadat je je atomaire ratio hebt gevonden, moet je alle deelnummers (opnieuw, zoals 1,33) converteren naar hele getallen (zoals 3). Om dit te doen, moet je een heel getal vinden dat vermenigvuldigd kan worden met elk individueel getal in je atoomverhouding om een heel getal te krijgen. Bijvoorbeeld:
5 Begrijpen hoe je aantallen atomaire verhoudingen omzet in hele getallen. Bij het schrijven van een empirische formule heb je hele getallen nodig. Dit betekent dat je een nummer zoals 1.33 niet kunt gebruiken. Nadat je je atomaire ratio hebt gevonden, moet je alle deelnummers (opnieuw, zoals 1,33) converteren naar hele getallen (zoals 3). Om dit te doen, moet je een heel getal vinden dat vermenigvuldigd kan worden met elk individueel getal in je atoomverhouding om een heel getal te krijgen. Bijvoorbeeld:  6 Begrijp wat die hele getallen betekenen voor de empirische formule. De hele cijferratio die we zojuist hebben opgelost, past eigenlijk in de empirische formule. Die drie hele getallen zijn de kleine cijfers die aan de voet van elke letter hangen die een afzonderlijk element van de verbinding vertegenwoordigt. Onze samengestelde empirische formule zou er bijvoorbeeld als volgt uitzien:
6 Begrijp wat die hele getallen betekenen voor de empirische formule. De hele cijferratio die we zojuist hebben opgelost, past eigenlijk in de empirische formule. Die drie hele getallen zijn de kleine cijfers die aan de voet van elke letter hangen die een afzonderlijk element van de verbinding vertegenwoordigt. Onze samengestelde empirische formule zou er bijvoorbeeld als volgt uitzien:  1 Bepaal de percentagesamenstelling van uw verbinding. Als u de empirische formule voor een huiswerkopdracht probeert te vinden, krijgt u hoogstwaarschijnlijk de percentagesamenstelling; u hoeft alleen maar te weten waar u moet zoeken. Bijvoorbeeld:
1 Bepaal de percentagesamenstelling van uw verbinding. Als u de empirische formule voor een huiswerkopdracht probeert te vinden, krijgt u hoogstwaarschijnlijk de percentagesamenstelling; u hoeft alleen maar te weten waar u moet zoeken. Bijvoorbeeld:  2 Zoek het aantal gram-atomen in de verbinding. Zoals besproken in Deel 1, is de vergelijking voor het vinden van het aantal gram-atomen: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element. Voor ons voorbeeld is de atomaire massa van koolstof 12, waterstof 1 en zuurstof 16.
2 Zoek het aantal gram-atomen in de verbinding. Zoals besproken in Deel 1, is de vergelijking voor het vinden van het aantal gram-atomen: Het percentage van het element in de verbinding (%) gedeeld door de atomaire massa van het element. Voor ons voorbeeld is de atomaire massa van koolstof 12, waterstof 1 en zuurstof 16. 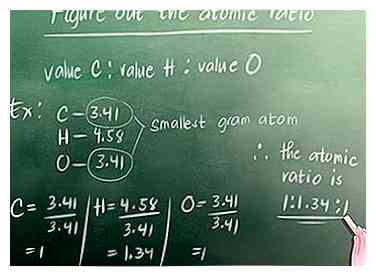 3 Bereken de atoomverhouding. Zoek naar het gram-atoom dat de kleinste is van alle gram-atomen die we net hebben berekend. Voor ons voorbeeld is dit 3,41 (koolstof of zuurstof - ze hebben allebei dezelfde waarde). Vervolgens moet u alle gram-atoomwaarden door dit getal verdelen. Je schrijft de verhouding als volgt: waarde Carbon: waarde Waterstof: waarde Zuurstof.
3 Bereken de atoomverhouding. Zoek naar het gram-atoom dat de kleinste is van alle gram-atomen die we net hebben berekend. Voor ons voorbeeld is dit 3,41 (koolstof of zuurstof - ze hebben allebei dezelfde waarde). Vervolgens moet u alle gram-atoomwaarden door dit getal verdelen. Je schrijft de verhouding als volgt: waarde Carbon: waarde Waterstof: waarde Zuurstof.  4 Converteer de verhouding naar hele getallen. Als je atoomverhouding hele getallen heeft, kun je deze stap overslaan. Voor ons voorbeeld moeten we echter 1.34 naar een geheel getal converteren.Ons kleinste hele getal dat vermenigvuldigd kan worden met de getallen in onze atoomverhouding om hele getallen te maken is 3.
4 Converteer de verhouding naar hele getallen. Als je atoomverhouding hele getallen heeft, kun je deze stap overslaan. Voor ons voorbeeld moeten we echter 1.34 naar een geheel getal converteren.Ons kleinste hele getal dat vermenigvuldigd kan worden met de getallen in onze atoomverhouding om hele getallen te maken is 3.  5 Schrijf de empirische formule op. Om dit te doen, hoef je alleen maar de letters van elke component te schrijven, in dit geval C voor koolstof, H voor waterstof en O voor zuurstof, met hun hele getallenteller als subscript. De empirische formule voor ons voorbeeld is:
5 Schrijf de empirische formule op. Om dit te doen, hoef je alleen maar de letters van elke component te schrijven, in dit geval C voor koolstof, H voor waterstof en O voor zuurstof, met hun hele getallenteller als subscript. De empirische formule voor ons voorbeeld is: