De gemiddelde atomaire massa is geen directe meting van een enkel atoom. In plaats daarvan is het de gemiddelde massa per atoom voor een typisch monster van een bepaald element. Als je de massa van miljarden individuele atomen zou kunnen meten, zou je deze waarde op dezelfde manier kunnen berekenen als je een bepaald gemiddelde zou vinden. Gelukkig is er een meer praktische methode die gebaseerd is op geregistreerde informatie over de zeldzaamheid van verschillende isotopen.
Deel een van de twee:
Berekening van de gemiddelde atomaire massa
-
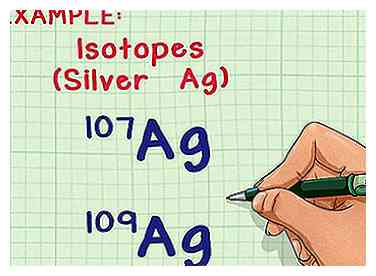 1 Isotopen en atoommassa's begrijpen. De meeste elementen kunnen van nature voorkomen in meerdere vormen, of isotopen. Het massagetal voor elke isotoop is de som van aantallen protonen en neutronen in de kern. Elk proton en elk neutron weegt 1 atomische massa-eenheid (amu).[1] Het enige verschil tussen twee isotopen van hetzelfde element is het aantal neutronen per atoom, dat de massa van het atoom beïnvloedt.[2] Het element heeft echter altijd hetzelfde aantal protonen.
1 Isotopen en atoommassa's begrijpen. De meeste elementen kunnen van nature voorkomen in meerdere vormen, of isotopen. Het massagetal voor elke isotoop is de som van aantallen protonen en neutronen in de kern. Elk proton en elk neutron weegt 1 atomische massa-eenheid (amu).[1] Het enige verschil tussen twee isotopen van hetzelfde element is het aantal neutronen per atoom, dat de massa van het atoom beïnvloedt.[2] Het element heeft echter altijd hetzelfde aantal protonen. - De gemiddelde atomaire massa van het element houdt rekening met de variaties van het aantal neutronen en vertelt u de gemiddelde massa per atoom in een typisch monster van dat element.
- Het element zilver (Ag) heeft bijvoorbeeld twee van nature voorkomende isotopen: Ag-107 en Ag-109 (of 107Ag en 109Ag).[3] Isotopen zijn genoemd naar het "massagetal" of de som van protonen en neutronen in één atoom.[4] Dit betekent dat Ag-109 nog twee neutronen per atoom heeft dan Ag-107, waardoor het iets meer massa krijgt.
-
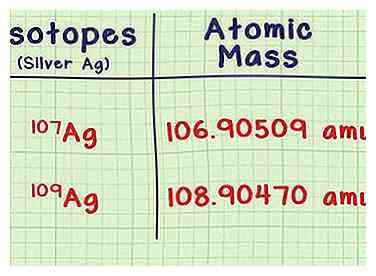 2 Zoek de massa op van elke isotoop. U hebt voor elke isotoop twee stukjes informatie nodig, die u in een naslagwerk of een online bron zoals webelements.com kunt opzoeken. De eerste is de atomaire massa, of de massa van één atoom van elke isotoop. Isotopen met meer neutronen hebben meer massa.
2 Zoek de massa op van elke isotoop. U hebt voor elke isotoop twee stukjes informatie nodig, die u in een naslagwerk of een online bron zoals webelements.com kunt opzoeken. De eerste is de atomaire massa, of de massa van één atoom van elke isotoop. Isotopen met meer neutronen hebben meer massa. - De zilveren isotoop Ag-107 heeft bijvoorbeeld een atoommassa van 106.90509 amu (atomaire massa-eenheden). De isotoop Ag-109 is iets zwaarder met een massa van 108.90470.
- De laatste paar decimalen kunnen in verschillende bronnen enigszins afwijken. Neem geen nummers tussen haakjes na de mis.
-
 3 Noteer de overvloed van elke isotoop. De overvloed vertelt je hoe algemeen de isotoop is, als een percentage van alle atomen van het element. Elke isotoop draagt proportioneel bij aan zijn overvloed (hoe meer overvloedig de isotoop is, hoe meer deze bijdraagt aan de gemiddelde atomaire massa). Je kunt dit vinden in dezelfde bron waar je de mis vond. De abundanties van alle isotopen moeten oplopen tot 100% (hoewel het enigszins kan afwijken vanwege afrondingsfouten).
3 Noteer de overvloed van elke isotoop. De overvloed vertelt je hoe algemeen de isotoop is, als een percentage van alle atomen van het element. Elke isotoop draagt proportioneel bij aan zijn overvloed (hoe meer overvloedig de isotoop is, hoe meer deze bijdraagt aan de gemiddelde atomaire massa). Je kunt dit vinden in dezelfde bron waar je de mis vond. De abundanties van alle isotopen moeten oplopen tot 100% (hoewel het enigszins kan afwijken vanwege afrondingsfouten). - De isotoop Ag-107 heeft een abundantie van 51,86%. Ag-109 komt iets minder vaak voor met een overvloed van 48.14%. Dit betekent dat een typisch monster van zilver 51.86% Ag-107 en 48.14% Ag-109 is.
- Negeer alle isotopen die geen overvloed hebben. Deze isotopen komen niet van nature op aarde voor.
-
 4 Verander uw abundantiepercentages in decimalen. Deel het abundantie-percentage met 100 om dezelfde waarde als een decimaal te krijgen.
4 Verander uw abundantiepercentages in decimalen. Deel het abundantie-percentage met 100 om dezelfde waarde als een decimaal te krijgen. - In het voorbeeldprobleem zijn de overvloedcijfers 51,86 / 100 = 0.5186 en 48.14 / 100 = 0.4814.
-
 5 Zoek het gewogen gemiddelde van de atomaire massa van zijn stabiele isotopen. De gemiddelde atomaire massa van een element met n isotopen is gelijk aan (massaisotoop 1 * overvloedisotoop 1) + (massaisotoop 2 * overvloedisotoop 2) + ... + (massaisotoop n * overvloedisotoop n.[5] Dit is een voorbeeld van een "gewogen gemiddelde", wat betekent dat meer voorkomende (meer overvloedige) massa's een groter effect hebben op het resultaat. Hier is hoe deze formule te gebruiken voor zilver:
5 Zoek het gewogen gemiddelde van de atomaire massa van zijn stabiele isotopen. De gemiddelde atomaire massa van een element met n isotopen is gelijk aan (massaisotoop 1 * overvloedisotoop 1) + (massaisotoop 2 * overvloedisotoop 2) + ... + (massaisotoop n * overvloedisotoop n.[5] Dit is een voorbeeld van een "gewogen gemiddelde", wat betekent dat meer voorkomende (meer overvloedige) massa's een groter effect hebben op het resultaat. Hier is hoe deze formule te gebruiken voor zilver: - Gemiddelde atomaire massaag = (massaAg-107 * overvloedAg-107) + (massaAg-109 * overvloedAg-109)
=(106.90509 * 0.5186) + (108.90470 * 0.4814)
= 55.4410 + 52.4267
= 107.8677 amu. - Zoek het element op een periodiek systeem op om uw antwoord te controleren. De gemiddelde atomaire massa wordt meestal onder het elementsymbool geschreven.[6]
- Gemiddelde atomaire massaag = (massaAg-107 * overvloedAg-107) + (massaAg-109 * overvloedAg-109)
Deel twee van twee:
Het resultaat gebruiken
-
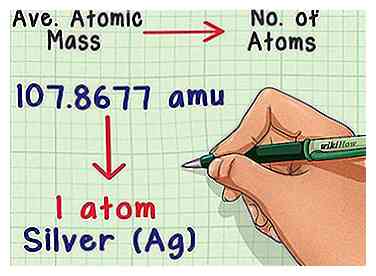 1 Converteer massa naar aantal atomen. De gemiddelde atoommassa vertelt je de relatie tussen massa en aantal atomen in een typisch monster van het element. Dit is handig in chemielaboratoria omdat het bijna onmogelijk is om het aantal atomen direct te tellen, maar eenvoudig om massa te meten. U kunt bijvoorbeeld een staal van zilver wegen en voorspellen dat elke 107.8677 amu aan massa één zilveratoom bevat.
1 Converteer massa naar aantal atomen. De gemiddelde atoommassa vertelt je de relatie tussen massa en aantal atomen in een typisch monster van het element. Dit is handig in chemielaboratoria omdat het bijna onmogelijk is om het aantal atomen direct te tellen, maar eenvoudig om massa te meten. U kunt bijvoorbeeld een staal van zilver wegen en voorspellen dat elke 107.8677 amu aan massa één zilveratoom bevat. -
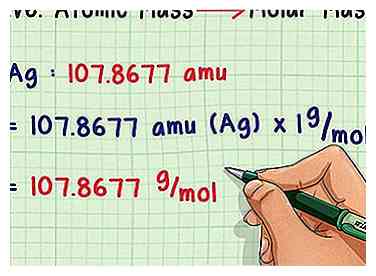 2 Omzetten in molaire massa. Atoommassa-eenheden zijn erg klein, dus chemici wegen doorgaans monsters in grammen in plaats daarvan. Gelukkig zijn deze concepten gedefinieerd om de conversie zo eenvoudig mogelijk te maken. Vermenigvuldig gewoon de gemiddelde atomaire massa met 1 g / mol (de constante molaire massa) om in plaats daarvan een antwoord in g / mol te krijgen. Bijvoorbeeld bevat 107.8677 gram zilver gemiddeld één mol aan zilveratomen.
2 Omzetten in molaire massa. Atoommassa-eenheden zijn erg klein, dus chemici wegen doorgaans monsters in grammen in plaats daarvan. Gelukkig zijn deze concepten gedefinieerd om de conversie zo eenvoudig mogelijk te maken. Vermenigvuldig gewoon de gemiddelde atomaire massa met 1 g / mol (de constante molaire massa) om in plaats daarvan een antwoord in g / mol te krijgen. Bijvoorbeeld bevat 107.8677 gram zilver gemiddeld één mol aan zilveratomen. -
 3 Vind de gemiddelde molecuulmassa. Omdat een molecuul slechts een verzameling atomen is, kun je de massa's van de atomen bij elkaar optellen om de massa van het molecuul te vinden. Als u de gemiddelde atomaire massa gebruikt (in plaats van de massa van een specifieke isotoop), is het antwoord de gemiddelde massa van het molecuul zoals gevonden in een natuurlijk voorkomend monster. Hier is een voorbeeld:
3 Vind de gemiddelde molecuulmassa. Omdat een molecuul slechts een verzameling atomen is, kun je de massa's van de atomen bij elkaar optellen om de massa van het molecuul te vinden. Als u de gemiddelde atomaire massa gebruikt (in plaats van de massa van een specifieke isotoop), is het antwoord de gemiddelde massa van het molecuul zoals gevonden in een natuurlijk voorkomend monster. Hier is een voorbeeld: - Een molecuul water heeft de chemische formule H2O, dus het bevat twee waterstof (H) -atomen en één zuurstof (O) -atoom.
- Waterstof heeft een gemiddelde atomaire massa van 1.00794 amu. Zuurstofatomen hebben een gemiddelde massa van 15.9994 amu.
- De gemiddelde massa van een molecuul van H2O is gelijk aan (1.00794) (2) + 15.9994 = 18.01528 amu, equivalent aan 18.01528 g / mol.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Isotopen en atoommassa's begrijpen. De meeste elementen kunnen van nature voorkomen in meerdere vormen, of isotopen. Het massagetal voor elke isotoop is de som van aantallen protonen en neutronen in de kern. Elk proton en elk neutron weegt 1 atomische massa-eenheid (amu).[1] Het enige verschil tussen twee isotopen van hetzelfde element is het aantal neutronen per atoom, dat de massa van het atoom beïnvloedt.[2] Het element heeft echter altijd hetzelfde aantal protonen.
1 Isotopen en atoommassa's begrijpen. De meeste elementen kunnen van nature voorkomen in meerdere vormen, of isotopen. Het massagetal voor elke isotoop is de som van aantallen protonen en neutronen in de kern. Elk proton en elk neutron weegt 1 atomische massa-eenheid (amu).[1] Het enige verschil tussen twee isotopen van hetzelfde element is het aantal neutronen per atoom, dat de massa van het atoom beïnvloedt.[2] Het element heeft echter altijd hetzelfde aantal protonen.  2 Zoek de massa op van elke isotoop. U hebt voor elke isotoop twee stukjes informatie nodig, die u in een naslagwerk of een online bron zoals webelements.com kunt opzoeken. De eerste is de atomaire massa, of de massa van één atoom van elke isotoop. Isotopen met meer neutronen hebben meer massa.
2 Zoek de massa op van elke isotoop. U hebt voor elke isotoop twee stukjes informatie nodig, die u in een naslagwerk of een online bron zoals webelements.com kunt opzoeken. De eerste is de atomaire massa, of de massa van één atoom van elke isotoop. Isotopen met meer neutronen hebben meer massa.  3 Noteer de overvloed van elke isotoop. De overvloed vertelt je hoe algemeen de isotoop is, als een percentage van alle atomen van het element. Elke isotoop draagt proportioneel bij aan zijn overvloed (hoe meer overvloedig de isotoop is, hoe meer deze bijdraagt aan de gemiddelde atomaire massa). Je kunt dit vinden in dezelfde bron waar je de mis vond. De abundanties van alle isotopen moeten oplopen tot 100% (hoewel het enigszins kan afwijken vanwege afrondingsfouten).
3 Noteer de overvloed van elke isotoop. De overvloed vertelt je hoe algemeen de isotoop is, als een percentage van alle atomen van het element. Elke isotoop draagt proportioneel bij aan zijn overvloed (hoe meer overvloedig de isotoop is, hoe meer deze bijdraagt aan de gemiddelde atomaire massa). Je kunt dit vinden in dezelfde bron waar je de mis vond. De abundanties van alle isotopen moeten oplopen tot 100% (hoewel het enigszins kan afwijken vanwege afrondingsfouten).  4 Verander uw abundantiepercentages in decimalen. Deel het abundantie-percentage met 100 om dezelfde waarde als een decimaal te krijgen.
4 Verander uw abundantiepercentages in decimalen. Deel het abundantie-percentage met 100 om dezelfde waarde als een decimaal te krijgen.  5 Zoek het gewogen gemiddelde van de atomaire massa van zijn stabiele isotopen. De gemiddelde atomaire massa van een element met n isotopen is gelijk aan (massaisotoop 1 * overvloedisotoop 1) + (massaisotoop 2 * overvloedisotoop 2) + ... + (massaisotoop n * overvloedisotoop n.[5] Dit is een voorbeeld van een "gewogen gemiddelde", wat betekent dat meer voorkomende (meer overvloedige) massa's een groter effect hebben op het resultaat. Hier is hoe deze formule te gebruiken voor zilver:
5 Zoek het gewogen gemiddelde van de atomaire massa van zijn stabiele isotopen. De gemiddelde atomaire massa van een element met n isotopen is gelijk aan (massaisotoop 1 * overvloedisotoop 1) + (massaisotoop 2 * overvloedisotoop 2) + ... + (massaisotoop n * overvloedisotoop n.[5] Dit is een voorbeeld van een "gewogen gemiddelde", wat betekent dat meer voorkomende (meer overvloedige) massa's een groter effect hebben op het resultaat. Hier is hoe deze formule te gebruiken voor zilver:  1 Converteer massa naar aantal atomen. De gemiddelde atoommassa vertelt je de relatie tussen massa en aantal atomen in een typisch monster van het element. Dit is handig in chemielaboratoria omdat het bijna onmogelijk is om het aantal atomen direct te tellen, maar eenvoudig om massa te meten. U kunt bijvoorbeeld een staal van zilver wegen en voorspellen dat elke 107.8677 amu aan massa één zilveratoom bevat.
1 Converteer massa naar aantal atomen. De gemiddelde atoommassa vertelt je de relatie tussen massa en aantal atomen in een typisch monster van het element. Dit is handig in chemielaboratoria omdat het bijna onmogelijk is om het aantal atomen direct te tellen, maar eenvoudig om massa te meten. U kunt bijvoorbeeld een staal van zilver wegen en voorspellen dat elke 107.8677 amu aan massa één zilveratoom bevat. 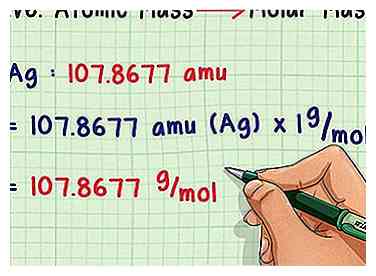 2 Omzetten in molaire massa. Atoommassa-eenheden zijn erg klein, dus chemici wegen doorgaans monsters in grammen in plaats daarvan. Gelukkig zijn deze concepten gedefinieerd om de conversie zo eenvoudig mogelijk te maken. Vermenigvuldig gewoon de gemiddelde atomaire massa met 1 g / mol (de constante molaire massa) om in plaats daarvan een antwoord in g / mol te krijgen. Bijvoorbeeld bevat 107.8677 gram zilver gemiddeld één mol aan zilveratomen.
2 Omzetten in molaire massa. Atoommassa-eenheden zijn erg klein, dus chemici wegen doorgaans monsters in grammen in plaats daarvan. Gelukkig zijn deze concepten gedefinieerd om de conversie zo eenvoudig mogelijk te maken. Vermenigvuldig gewoon de gemiddelde atomaire massa met 1 g / mol (de constante molaire massa) om in plaats daarvan een antwoord in g / mol te krijgen. Bijvoorbeeld bevat 107.8677 gram zilver gemiddeld één mol aan zilveratomen.  3 Vind de gemiddelde molecuulmassa. Omdat een molecuul slechts een verzameling atomen is, kun je de massa's van de atomen bij elkaar optellen om de massa van het molecuul te vinden. Als u de gemiddelde atomaire massa gebruikt (in plaats van de massa van een specifieke isotoop), is het antwoord de gemiddelde massa van het molecuul zoals gevonden in een natuurlijk voorkomend monster. Hier is een voorbeeld:
3 Vind de gemiddelde molecuulmassa. Omdat een molecuul slechts een verzameling atomen is, kun je de massa's van de atomen bij elkaar optellen om de massa van het molecuul te vinden. Als u de gemiddelde atomaire massa gebruikt (in plaats van de massa van een specifieke isotoop), is het antwoord de gemiddelde massa van het molecuul zoals gevonden in een natuurlijk voorkomend monster. Hier is een voorbeeld: