Het atoomnummer van een element is het aantal protonen in de kern van een enkel atoom van dat element. Het atoomnummer van een element of isotoop kan niet veranderen, dus je kunt het atoomnummer gebruiken om andere kenmerken te achterhalen, zoals het aantal elektronen en neutronen in een atoom.
Deel een van de twee:
Het atoomnummer vinden
-
 1 Zoek een kopie van het periodiek systeem. We hebben er hier een als je er geen bij de hand hebt. Elk afzonderlijk element heeft een ander atoomnummer en de elementen worden op basis van hun atoomnummers op de tafel gerangschikt. Het is ofwel een kopie van het periodiek systeem, ofwel een uit het hoofd leren.
1 Zoek een kopie van het periodiek systeem. We hebben er hier een als je er geen bij de hand hebt. Elk afzonderlijk element heeft een ander atoomnummer en de elementen worden op basis van hun atoomnummers op de tafel gerangschikt. Het is ofwel een kopie van het periodiek systeem, ofwel een uit het hoofd leren. - De meeste scheikundeboeken hebben een periodiek systeem gedrukt op de binnenkant van de omslag.
-
 2 Zoek het element dat je studeert. De meeste periodieke tabellen bevatten de volledige naam van de elementen, evenals het chemische symbool (zoals Hg voor Mercurius). Als u problemen ondervindt om het te vinden, zoek dan online naar 'chemisch symbool' gevolgd door de naam van het element.
2 Zoek het element dat je studeert. De meeste periodieke tabellen bevatten de volledige naam van de elementen, evenals het chemische symbool (zoals Hg voor Mercurius). Als u problemen ondervindt om het te vinden, zoek dan online naar 'chemisch symbool' gevolgd door de naam van het element. -
 3 Zoek naar het atoomnummer. Het atoomnummer bevindt zich meestal in de linkerboven- of rechterbovenhoek van de doos van het element, maar kan zich op een andere plek bevinden. Dit is altijd een heel getal.
3 Zoek naar het atoomnummer. Het atoomnummer bevindt zich meestal in de linkerboven- of rechterbovenhoek van de doos van het element, maar kan zich op een andere plek bevinden. Dit is altijd een heel getal. - Als het getal een decimaalteken bevat, kijk je waarschijnlijk naar atomaire massa.
-
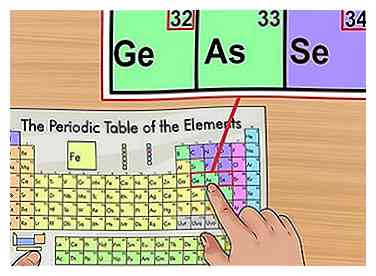 4 Bevestig op basis van elementen in de buurt. Het periodiek systeem is gerangschikt in volgorde van atoomnummer. Als het atoomnummer van je element "33" is, moet het element aan de linkerkant "32" zijn en het element aan de rechterkant een "34". Als dit patroon waar is, heb je zeker het atoomnummer gevonden.
4 Bevestig op basis van elementen in de buurt. Het periodiek systeem is gerangschikt in volgorde van atoomnummer. Als het atoomnummer van je element "33" is, moet het element aan de linkerkant "32" zijn en het element aan de rechterkant een "34". Als dit patroon waar is, heb je zeker het atoomnummer gevonden. - Mogelijk ziet u hiaten na elementen 56 (Barium) en 88 (Radium). Er is geen echte kloof; de elementen met die atoomnummers bevinden zich in twee rijen onder de rest van de grafiek. Ze zijn alleen zo gescheiden dat ze passen in het periodiek systeem in een smallere vorm.
-
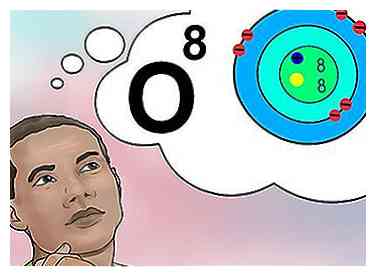 5 Begrijp het atoomnummer. Het atoomnummer van een element heeft een eenvoudige definitie: het aantal protonen in één atoom van dat element.[1] Dit is de fundamentele definitie van een element. Het aantal protonen bepaalt de totale elektrische lading van de kern, die bepaalt hoeveel elektronen het atoom kan ondersteunen. Omdat elektronen verantwoordelijk zijn voor bijna alle chemische interacties, stelt het atoomnummer indirect vrijwel alle fysieke en chemische eigenschappen van het element vast.
5 Begrijp het atoomnummer. Het atoomnummer van een element heeft een eenvoudige definitie: het aantal protonen in één atoom van dat element.[1] Dit is de fundamentele definitie van een element. Het aantal protonen bepaalt de totale elektrische lading van de kern, die bepaalt hoeveel elektronen het atoom kan ondersteunen. Omdat elektronen verantwoordelijk zijn voor bijna alle chemische interacties, stelt het atoomnummer indirect vrijwel alle fysieke en chemische eigenschappen van het element vast. - Om het anders te zeggen, elk atoom met acht protonen is een zuurstofatoom. Twee zuurstofatomen kunnen verschillende aantallen neutronen hebben of (als één een ion is) verschillende aantallen elektronen, maar ze zullen altijd altijd acht protonen bevatten.
Deel twee van twee:
Verwante informatie zoeken
-
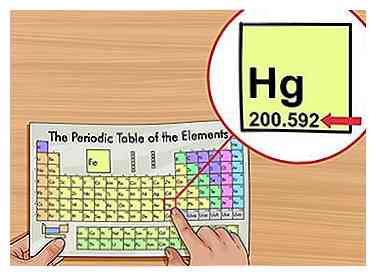 1 Zoek het atoomgewicht. Het atoomgewicht wordt meestal afgedrukt onder de elementnaam op het periodiek systeem, meestal tot twee of drie decimalen. Dit is de gemiddelde massa van één atoom van het element, gewogen met wat je zou verwachten te vinden in de natuur. Dit aantal bevindt zich in "atomic mass units" (AMU).
1 Zoek het atoomgewicht. Het atoomgewicht wordt meestal afgedrukt onder de elementnaam op het periodiek systeem, meestal tot twee of drie decimalen. Dit is de gemiddelde massa van één atoom van het element, gewogen met wat je zou verwachten te vinden in de natuur. Dit aantal bevindt zich in "atomic mass units" (AMU). - Sommige wetenschappers geven de voorkeur aan de term "relatieve atomaire massa" in plaats van aan atoomgewicht.[2]
-
 2 Rond naar het massagetal. Het massagetal is het totale aantal protonen en neutronen in een atoom van een element. Dit is gemakkelijk te vinden: gebruik gewoon het atoomgewicht dat op het periodiek systeem is afgedrukt en rond naar het dichtstbijzijnde hele getal.[3]
2 Rond naar het massagetal. Het massagetal is het totale aantal protonen en neutronen in een atoom van een element. Dit is gemakkelijk te vinden: gebruik gewoon het atoomgewicht dat op het periodiek systeem is afgedrukt en rond naar het dichtstbijzijnde hele getal.[3] - Dit werkt omdat neutronen en protonen beide dicht bij 1 AMU liggen en elektronen dicht bij 0 AMU liggen. Het atoomgewicht gebruikt nauwkeurige metingen om de decimale waarde te krijgen, maar we zijn alleen geïnteresseerd in de hele getallen die ons het aantal protonen en neutronen vertellen.
- Houd er rekening mee dat als u het atoomgewicht gebruikt, u een gemiddelde krijgt voor een standaardvoorbeeld. Een broommonster heeft een gemiddeld massagetal van 80, maar het blijkt dat een enkel broomatoom bijna altijd een massagetal van 79 of 81 heeft.[4]
- 3 Zoek het aantal elektronen. Atomen bevatten hetzelfde aantal protonen en elektronen, dus deze aantallen zullen hetzelfde zijn. Elektronen zijn negatief geladen, dus ze balanceren en neutraliseren de protonen, die positief geladen zijn.[5]
- Als een atoom elektronen verliest of wint, wordt het een ion, wat betekent dat het een elektrisch geladen atoom is.
-
 4 Bereken het aantal neutronen. Nu weet je dat het aantal atomen = aantal protonen en massagetal = aantal protonen + aantal neutronen. Om het aantal neutronen in een element te vinden, trekt u het atoomnummer van het massagetal af. Hier zijn een paar voorbeelden:
4 Bereken het aantal neutronen. Nu weet je dat het aantal atomen = aantal protonen en massagetal = aantal protonen + aantal neutronen. Om het aantal neutronen in een element te vinden, trekt u het atoomnummer van het massagetal af. Hier zijn een paar voorbeelden: - Een enkel helium (He) atoom heeft een massagetal van 4 en een atoomnummer van 2. Het moet 4 - 2 = hebben 2 neutronen.
- Een staal van zilver (Ag) heeft een gemiddeld massagetal van 108 (op basis van het periodiek systeem) en een atoomnummer van 47. Gemiddeld heeft elk zilveratoom in het monster 108 - 47 = 61 neutronen.
-
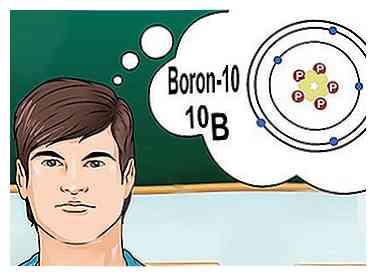 5 Isotopen begrijpen. Een isotoop is een specifieke vorm van een element, met een bepaald aantal neutronen. Als een chemisch probleem 'borium-10' of '10B, "het gaat om boorelementen met een massagetal van 10.[6] Gebruik dit massagetal in plaats van de waarden voor 'typisch' boor.
5 Isotopen begrijpen. Een isotoop is een specifieke vorm van een element, met een bepaald aantal neutronen. Als een chemisch probleem 'borium-10' of '10B, "het gaat om boorelementen met een massagetal van 10.[6] Gebruik dit massagetal in plaats van de waarden voor 'typisch' boor. - Isotopen veranderen nooit het atoomnummer. Elke isotoop van een element heeft hetzelfde aantal protonen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Zoek een kopie van het periodiek systeem. We hebben er hier een als je er geen bij de hand hebt. Elk afzonderlijk element heeft een ander atoomnummer en de elementen worden op basis van hun atoomnummers op de tafel gerangschikt. Het is ofwel een kopie van het periodiek systeem, ofwel een uit het hoofd leren.
1 Zoek een kopie van het periodiek systeem. We hebben er hier een als je er geen bij de hand hebt. Elk afzonderlijk element heeft een ander atoomnummer en de elementen worden op basis van hun atoomnummers op de tafel gerangschikt. Het is ofwel een kopie van het periodiek systeem, ofwel een uit het hoofd leren.  2 Zoek het element dat je studeert. De meeste periodieke tabellen bevatten de volledige naam van de elementen, evenals het chemische symbool (zoals Hg voor Mercurius). Als u problemen ondervindt om het te vinden, zoek dan online naar 'chemisch symbool' gevolgd door de naam van het element.
2 Zoek het element dat je studeert. De meeste periodieke tabellen bevatten de volledige naam van de elementen, evenals het chemische symbool (zoals Hg voor Mercurius). Als u problemen ondervindt om het te vinden, zoek dan online naar 'chemisch symbool' gevolgd door de naam van het element.  3 Zoek naar het atoomnummer. Het atoomnummer bevindt zich meestal in de linkerboven- of rechterbovenhoek van de doos van het element, maar kan zich op een andere plek bevinden. Dit is altijd een heel getal.
3 Zoek naar het atoomnummer. Het atoomnummer bevindt zich meestal in de linkerboven- of rechterbovenhoek van de doos van het element, maar kan zich op een andere plek bevinden. Dit is altijd een heel getal.  4 Bevestig op basis van elementen in de buurt. Het periodiek systeem is gerangschikt in volgorde van atoomnummer. Als het atoomnummer van je element "33" is, moet het element aan de linkerkant "32" zijn en het element aan de rechterkant een "34". Als dit patroon waar is, heb je zeker het atoomnummer gevonden.
4 Bevestig op basis van elementen in de buurt. Het periodiek systeem is gerangschikt in volgorde van atoomnummer. Als het atoomnummer van je element "33" is, moet het element aan de linkerkant "32" zijn en het element aan de rechterkant een "34". Als dit patroon waar is, heb je zeker het atoomnummer gevonden.  5 Begrijp het atoomnummer. Het atoomnummer van een element heeft een eenvoudige definitie: het aantal protonen in één atoom van dat element.[1] Dit is de fundamentele definitie van een element. Het aantal protonen bepaalt de totale elektrische lading van de kern, die bepaalt hoeveel elektronen het atoom kan ondersteunen. Omdat elektronen verantwoordelijk zijn voor bijna alle chemische interacties, stelt het atoomnummer indirect vrijwel alle fysieke en chemische eigenschappen van het element vast.
5 Begrijp het atoomnummer. Het atoomnummer van een element heeft een eenvoudige definitie: het aantal protonen in één atoom van dat element.[1] Dit is de fundamentele definitie van een element. Het aantal protonen bepaalt de totale elektrische lading van de kern, die bepaalt hoeveel elektronen het atoom kan ondersteunen. Omdat elektronen verantwoordelijk zijn voor bijna alle chemische interacties, stelt het atoomnummer indirect vrijwel alle fysieke en chemische eigenschappen van het element vast.  1 Zoek het atoomgewicht. Het atoomgewicht wordt meestal afgedrukt onder de elementnaam op het periodiek systeem, meestal tot twee of drie decimalen. Dit is de gemiddelde massa van één atoom van het element, gewogen met wat je zou verwachten te vinden in de natuur. Dit aantal bevindt zich in "atomic mass units" (AMU).
1 Zoek het atoomgewicht. Het atoomgewicht wordt meestal afgedrukt onder de elementnaam op het periodiek systeem, meestal tot twee of drie decimalen. Dit is de gemiddelde massa van één atoom van het element, gewogen met wat je zou verwachten te vinden in de natuur. Dit aantal bevindt zich in "atomic mass units" (AMU).  2 Rond naar het massagetal. Het massagetal is het totale aantal protonen en neutronen in een atoom van een element. Dit is gemakkelijk te vinden: gebruik gewoon het atoomgewicht dat op het periodiek systeem is afgedrukt en rond naar het dichtstbijzijnde hele getal.[3]
2 Rond naar het massagetal. Het massagetal is het totale aantal protonen en neutronen in een atoom van een element. Dit is gemakkelijk te vinden: gebruik gewoon het atoomgewicht dat op het periodiek systeem is afgedrukt en rond naar het dichtstbijzijnde hele getal.[3]  4 Bereken het aantal neutronen. Nu weet je dat het aantal atomen = aantal protonen en massagetal = aantal protonen + aantal neutronen. Om het aantal neutronen in een element te vinden, trekt u het atoomnummer van het massagetal af. Hier zijn een paar voorbeelden:
4 Bereken het aantal neutronen. Nu weet je dat het aantal atomen = aantal protonen en massagetal = aantal protonen + aantal neutronen. Om het aantal neutronen in een element te vinden, trekt u het atoomnummer van het massagetal af. Hier zijn een paar voorbeelden:  5 Isotopen begrijpen. Een isotoop is een specifieke vorm van een element, met een bepaald aantal neutronen. Als een chemisch probleem 'borium-10' of '10B, "het gaat om boorelementen met een massagetal van 10.[6] Gebruik dit massagetal in plaats van de waarden voor 'typisch' boor.
5 Isotopen begrijpen. Een isotoop is een specifieke vorm van een element, met een bepaald aantal neutronen. Als een chemisch probleem 'borium-10' of '10B, "het gaat om boorelementen met een massagetal van 10.[6] Gebruik dit massagetal in plaats van de waarden voor 'typisch' boor.