In een chemische reactie kan materie noch gecreëerd of vernietigd worden volgens de Wet van Behoud van Massa, dus de producten die uit een reactie komen, moeten gelijk zijn aan de reactanten die in een reactie reageren. Dit betekent dat dezelfde hoeveelheid van elk atoom dat je erin steekt terug moet komen. Stoichiometrie is de maat voor de elementen in een reactie.[1] Het gaat om berekeningen die rekening houden met de massa's van reactanten en producten in een bepaalde chemische reactie. Stoichiometrie is een half wiskunde, een half scheikunde, en draait om het enige simpele principe hierboven - het principe dat materie nooit verloren gaat of opgedaan wordt tijdens een reactie. De eerste stap bij het oplossen van een chemieprobleem is om de vergelijking in evenwicht te brengen.
Deel een van de vier:
De chemische vergelijking in balans brengen
-
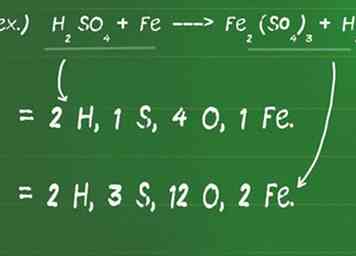 1 Noteer het aantal atomen dat elke verbinding aan weerszijden van de vergelijking bevat. Met behulp van de chemische vergelijking kun je de atomen van elk element in de reactie identificeren. Omdat een chemische reactie nooit nieuwe materie kan creëren of vernietigen, is een gegeven vergelijking onevenwichtig als het aantal (en typen) atomen aan elke kant van de vergelijking niet perfect overeenkomt.
1 Noteer het aantal atomen dat elke verbinding aan weerszijden van de vergelijking bevat. Met behulp van de chemische vergelijking kun je de atomen van elk element in de reactie identificeren. Omdat een chemische reactie nooit nieuwe materie kan creëren of vernietigen, is een gegeven vergelijking onevenwichtig als het aantal (en typen) atomen aan elke kant van de vergelijking niet perfect overeenkomt. - Vergeet niet te vermenigvuldigen met een coëfficiënt of subscript als er een aanwezig is.
- Bijvoorbeeld H2ZO4 + Fe ---> Fe2(ZO4)3 + H2
- Aan de reactant (links) kant van de vergelijking zijn er 2 H-atomen (H2), 1S-atoom, 4 O-atomen (O4) en 1 Fe-atoom.
- Op de product (rechts) kant van de vergelijking zijn er 2H-atomen (H2), 3 S-atomen (S.3), 12 O-atomen (O 12) en 2 Fe-atomen (Fe2).
-
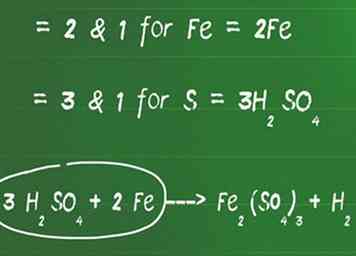 2 Voeg een coëfficiënt toe aan elementen die geen zuurstof en waterstof zijn om elke zijde in balans te brengen. Identificeer de kleinste gemene deler tussen alle elementen die geen zuurstof en waterstof zijn (je zult deze vervolgens in evenwicht brengen) om aan beide kanten evenveel atomen te krijgen.
2 Voeg een coëfficiënt toe aan elementen die geen zuurstof en waterstof zijn om elke zijde in balans te brengen. Identificeer de kleinste gemene deler tussen alle elementen die geen zuurstof en waterstof zijn (je zult deze vervolgens in evenwicht brengen) om aan beide kanten evenveel atomen te krijgen. - De laagste gemene factor tussen 2 en 1 is bijvoorbeeld 2 voor Fe. Voeg een 2 toe voor de Fe aan de linkerkant om het in evenwicht te brengen.
- De laagste gemeenschappelijke factor tussen 3 en 1 is 3 voor S. Voeg een 3 toe voor H2ZO4 om de linker- en rechterkant te balanceren.
- In dit stadium ziet onze vergelijking er als volgt uit: 3 H2ZO4 + 2 Fe ---> Fe2(ZO4)3 + H2
-
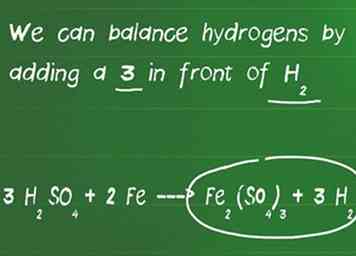 3 Breng de waterstof- en zuurstofatomen in evenwicht. Waterstof- en zuurstofatomen zijn als laatste in balans, omdat ze vaak voorkomen in meerdere moleculen aan elke zijde van de vergelijking. In dit stadium van het in balans brengen van de vergelijking, vergeet niet om de atomen opnieuw te vertellen als je coëfficiënten hebt toegevoegd aan moleculen.
3 Breng de waterstof- en zuurstofatomen in evenwicht. Waterstof- en zuurstofatomen zijn als laatste in balans, omdat ze vaak voorkomen in meerdere moleculen aan elke zijde van de vergelijking. In dit stadium van het in balans brengen van de vergelijking, vergeet niet om de atomen opnieuw te vertellen als je coëfficiënten hebt toegevoegd aan moleculen. - In ons voorbeeld hebben we een 3 toegevoegd voor H2ZO4 en hebben nu 6 waterstofatomen aan de linkerkant en slechts 2 aan de rechterkant van de vergelijking. We hebben ook 12 zuurstof aan de linkerkant en 12 zuurstof aan de rechterkant, dus het is in evenwicht.
- We kunnen waterstofatomen in balans brengen door een 3 toe te voegen voor H2.
- Onze uiteindelijke gebalanceerde vergelijking is 3 H2ZO4 + 2 Fe ---> Fe2(ZO4)3 + 3 H2.
-
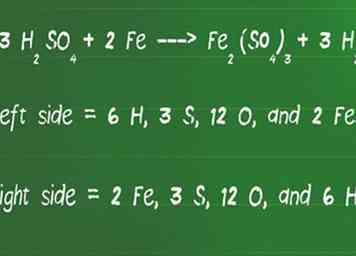 4 Hertel het aantal atomen aan elke kant van de vergelijking om ervoor te zorgen dat ze gelijk zijn. Als je klaar bent, is het slim om terug te gaan en de vergelijking te controleren op balans. Dit kan gedaan worden door opnieuw alle atomen aan weerszijden van de vergelijking bij elkaar op te tellen om ervoor te zorgen dat ze aan beide kanten gelijk zijn.
4 Hertel het aantal atomen aan elke kant van de vergelijking om ervoor te zorgen dat ze gelijk zijn. Als je klaar bent, is het slim om terug te gaan en de vergelijking te controleren op balans. Dit kan gedaan worden door opnieuw alle atomen aan weerszijden van de vergelijking bij elkaar op te tellen om ervoor te zorgen dat ze aan beide kanten gelijk zijn. - Laten we onze vergelijking bekijken, 3 H2ZO4 + 2 Fe ---> Fe2(ZO4)3 + 3 H2, voor balans.
- Aan de linkerkant van de pijl zijn er 6 H, 3 S, 12 O en 2 Fe.
- Aan de rechterkant van de pijl zijn er 2 Fe, 3 S, 12 O en 6 H.
- De linker- en rechterzijde van de vergelijking zijn daarom nu in evenwicht.
Deel twee van vier:
Converteren tussen gram en mollen
-
 1 Bereken de molecuulmassa van de verbinding in gram. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding.[2] Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten.[3] Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in de verbinding bevinden en de atomaire massa van elk element in de verbinding.
1 Bereken de molecuulmassa van de verbinding in gram. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding.[2] Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten.[3] Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in de verbinding bevinden en de atomaire massa van elk element in de verbinding. - Definieer het aantal atomen van elk element in een verbinding. Glucose is bijvoorbeeld C6H12O6er zijn 6 koolstofatomen, 12 waterstofatomen en 6 zuurstofatomen.
- Identificeer de atomaire massa in gram per mol (g / mol) van elk atoom. De atoommassa's van elk element worden meestal gevonden onder het symbool van het element op een periodiek systeem, meestal als een decimaal. De atomaire massa's van de elementen in glucose zijn: koolstof, 12,0107 g / mol; waterstof, 1,007 g / mol; en zuurstof, 15,9994 g / mol.
- Vermenigvuldig de atomaire massa van elk element met het aantal atomen dat aanwezig is in de verbinding. Koolstof: 12.0107 x 6 = 72.0642 g / mol; Waterstof: 1,007 x 12 = 12,084 g / mol; Zuurstof: 15.9994 x 6 = 95.9964 g / mol.
- Het toevoegen van deze producten levert de molaire massa van de verbinding op. 72.0642 + 12.084 + 95.9964 = 180.1446 g / mol. 180,14 gram is de massa van één mol glucose.
-
 2 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[4][5] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven.
2 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[4][5] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven. - Bijvoorbeeld: Hoeveel mol bevat 8,2 gram waterstofchloride (HCl)?
- De atomaire massa van H is 1.007 en Cl is 35.453 waardoor het molecuulgewicht van de verbinding 1.007 + 35.453 = 36.46 g / mol wordt gemaakt.
- Het verdelen van het aantal grammen van de substantie door de molaire massa levert op: 8,2 g / (36,46 g / mol) = 0,225 mol HC1.
-
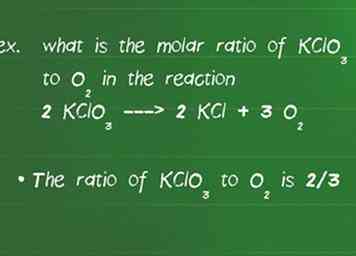 3 Bepaal de molverhouding tussen reactanten. Om de opbrengst van een product in een gegeven reactie te bepalen, moet u de molaire verhouding bepalen.De molverhouding vertelt u de verhouding waarin stoffen met elkaar reageren en wordt gegeven door de coëfficiënt van de soort in de uitgebalanceerde reactie.[6]
3 Bepaal de molverhouding tussen reactanten. Om de opbrengst van een product in een gegeven reactie te bepalen, moet u de molaire verhouding bepalen.De molverhouding vertelt u de verhouding waarin stoffen met elkaar reageren en wordt gegeven door de coëfficiënt van de soort in de uitgebalanceerde reactie.[6] - Wat is bijvoorbeeld de molaire verhouding van KClO3 naar O2 in de reactie 2 KC13 ---> 2 KCl + 3 O2.
- Controleer eerst of de vergelijking in evenwicht is. Vergeet deze stap nooit of uw verhoudingen kloppen niet. In dit geval zijn er gelijke hoeveelheden van elk element aan beide zijden van de reactie, zodat het in evenwicht is.
- De verhouding van KClO3 naar O2 is 2/3. Het maakt niet uit welk getal bovenaan of onderaan komt zolang u dezelfde verbindingen aan de boven- en onderkant behoudt gedurende de rest van het probleem.[7]
-
 4 Cross-vermenigvuldigen met de molaire verhouding om mol van andere reactant te vinden. Om het aantal mol van een soort geproduceerd of vereist voor een reactie te berekenen, gebruikt u de molaire verhouding.[8] Bij problemen wordt u meestal gevraagd om het aantal vereiste mol of het aantal mol geproduceerd in een reactie, gegeven een bepaald aantal gram reagens, te bepalen.
4 Cross-vermenigvuldigen met de molaire verhouding om mol van andere reactant te vinden. Om het aantal mol van een soort geproduceerd of vereist voor een reactie te berekenen, gebruikt u de molaire verhouding.[8] Bij problemen wordt u meestal gevraagd om het aantal vereiste mol of het aantal mol geproduceerd in een reactie, gegeven een bepaald aantal gram reagens, te bepalen. - Bijvoorbeeld gezien de reactie N2 + 3 H2 ---> 2 NH3 hoeveel mollen NH3 zal geproduceerd worden gegeven 3,00 gram N2 reageren met voldoende H2?
- In dit voorbeeld voldoende H2 betekent dat er voldoende beschikbaar is en dat u er geen rekening mee hoeft te houden om het probleem op te lossen.
- Converteer eerst gram N2 naar mollen. De atomaire massa van stikstof is 14.0067 g / mol, dus de molaire massa van N2 is 28.0134 g / mol. Door de massa te delen door de molmassa krijgt u 3,00 g / 28,0134 g / mol = 0,107 mol.
- Stel de verhoudingen in die worden gegeven door de vraag: NH3: N2 = x / 0.107 mol.
- Kruis vermenigvuldig deze verhouding met de molaire verhouding van NH3 naar N2: 2: 1. x / 0.107 mol = 2/1 = (2 x 0.107) = 1x = 0.214 mol.
-
 5 Zet mol terug naar massa met behulp van de molecuulmassa van de soort. U zult opnieuw molmassa gebruiken, maar deze keer zult u zich vermenigvuldigen om mollen terug naar gram om te rekenen. Zorg ervoor dat u de molecuulmassa van de juiste soort gebruikt.
5 Zet mol terug naar massa met behulp van de molecuulmassa van de soort. U zult opnieuw molmassa gebruiken, maar deze keer zult u zich vermenigvuldigen om mollen terug naar gram om te rekenen. Zorg ervoor dat u de molecuulmassa van de juiste soort gebruikt. - De molecuulmassa van NH3 is 17,028 g / mol. Daarom was 0,214 mol x (17,028 gram / mol) = 3,694 gram NH3.
Deel drie van vier:
Converteren tussen liter gas en mollen
-
 1 Bepaal of de reactie plaatsvindt bij standaard temperatuur en druk (STP). STP is de verzameling gegeven omstandigheden waarbij 1 mol van een ideaal gas 22,414 liter (L) volume zal innemen.[9] Standaardtemperatuur is 273,15 Kelvin (K) en standaarddruk is 1 atmosfeer (atm).[10]
1 Bepaal of de reactie plaatsvindt bij standaard temperatuur en druk (STP). STP is de verzameling gegeven omstandigheden waarbij 1 mol van een ideaal gas 22,414 liter (L) volume zal innemen.[9] Standaardtemperatuur is 273,15 Kelvin (K) en standaarddruk is 1 atmosfeer (atm).[10] - Over het algemeen zal een reactie zeggen dat deze wordt gegeven bij 1 atm en 273 K of gewoon STP zal zeggen.
-
 2 Gebruik de conversiefactor 22.414 L / mol om liters gas om te zetten in mollen. Als uw reactie plaatsvindt bij STP, kunt u 22.414 L / mol gebruiken om het aantal mol in een bepaald volume gas te berekenen.[11] Deel het volume van gas (L) door de conversiefactor om mollen te bepalen.
2 Gebruik de conversiefactor 22.414 L / mol om liters gas om te zetten in mollen. Als uw reactie plaatsvindt bij STP, kunt u 22.414 L / mol gebruiken om het aantal mol in een bepaald volume gas te berekenen.[11] Deel het volume van gas (L) door de conversiefactor om mollen te bepalen. - Converteer bijvoorbeeld 3,2 liter N2 van gas tot molen: 3,2 L / 22,414 L / mol = 0,143 mol.
-
 3 Gebruik de ideale gaswet om liters gas niet bij STP om te zetten. Als u een reactie krijgt die niet bij STP voorkomt, moet u de ideale gaswet PV = nRT gebruiken om het aantal moedervlekken in de reactie te bepalen.[12] P is druk in atmosferen, V is volume in liters, n is het aantal mol, R is de gaswetconstante 0,0821 L-atm / mol-graad en T is de temperatuur in graden Kelvin.[13]
3 Gebruik de ideale gaswet om liters gas niet bij STP om te zetten. Als u een reactie krijgt die niet bij STP voorkomt, moet u de ideale gaswet PV = nRT gebruiken om het aantal moedervlekken in de reactie te bepalen.[12] P is druk in atmosferen, V is volume in liters, n is het aantal mol, R is de gaswetconstante 0,0821 L-atm / mol-graad en T is de temperatuur in graden Kelvin.[13] - De vergelijking kan worden herschikt om mollen op te lossen: n = RT / PV.
- De eenheden van de gasconstante zijn ontworpen om de eenheden van de andere variabelen uit te schakelen.
- Bepaal bijvoorbeeld het aantal molen in 2,4 liter O2 bij 300 K en 1,5 atm. Het inpluggen van de variabelen levert op: n = (0.0821 x 300) / (1.5 x 2) = 24.63 / 3.6 = 6.842 mol O2
Deel vier van vier:
Converteren tussen liter vloeistof en mollen
-
 1 Bereken de dichtheid van de vloeistof. Soms geven chemische vergelijkingen u het volume van een vloeibaar reagens en vereisen de hoeveelheid gram of aantal mol die nodig is voor de reactie. Om te converteren naar grammen, gebruikt u de dichtheid van die vloeistof. De dichtheid wordt gegeven door massa / volume.[14]
1 Bereken de dichtheid van de vloeistof. Soms geven chemische vergelijkingen u het volume van een vloeibaar reagens en vereisen de hoeveelheid gram of aantal mol die nodig is voor de reactie. Om te converteren naar grammen, gebruikt u de dichtheid van die vloeistof. De dichtheid wordt gegeven door massa / volume.[14] - Als de dichtheid niet wordt aangegeven in het probleem, moet u dit misschien opzoeken in een referentietekst of online.
-
 2 Zet het volume om naar milliliters (ml). Om het volume van vloeistof naar massa (g) om te rekenen, moet je de dichtheid van die vloeistof gebruiken. De dichtheid wordt gegeven in grammen per milliliter (g / ml), daarom moet het volume van de vloeistof in milliliter omgezet worden.
2 Zet het volume om naar milliliters (ml). Om het volume van vloeistof naar massa (g) om te rekenen, moet je de dichtheid van die vloeistof gebruiken. De dichtheid wordt gegeven in grammen per milliliter (g / ml), daarom moet het volume van de vloeistof in milliliter omgezet worden. - Identificeer het gegeven volume. Laten we zeggen dat het probleem bijvoorbeeld stelt dat u 1 liter H hebt2O. Omzetten naar mL vermenigvuldigt u eenvoudig met 1000. Er zijn 1000 milliliter in een liter water.
-
 3 Vermenigvuldig het volume met de dichtheid. Wanneer u een volume (mL) vermenigvuldigt met de dichtheid van die vloeistof (g / mL), worden de milliliter geannuleerd en blijft er gram van de stof over.[15]
3 Vermenigvuldig het volume met de dichtheid. Wanneer u een volume (mL) vermenigvuldigt met de dichtheid van die vloeistof (g / mL), worden de milliliter geannuleerd en blijft er gram van de stof over.[15] - De dichtheid van H2O, bijvoorbeeld, is ongeveer 1,0 g / ml.[16]
-
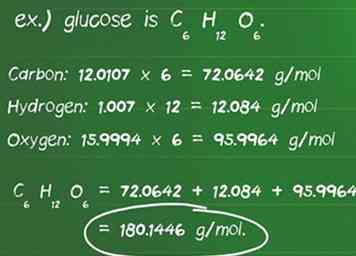 4 Bereken de molaire massa van de reactant. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding. Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten. Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in een verbinding bevinden en de atomaire massa van elk element in de verbinding.
4 Bereken de molaire massa van de reactant. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding. Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten. Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in een verbinding bevinden en de atomaire massa van elk element in de verbinding. - Definieer het aantal atomen van elk element in een verbinding. Glucose is bijvoorbeeld C6H12O6er zijn 6 koolstofatomen, 12 waterstofatomen en 6 zuurstofatomen.
- Identificeer de atomaire massa in gram per mol (g / mol) van elk atoom. De atomaire massa's van de elementen in glucose zijn: koolstof, 12,0107 g / mol; waterstof, 1,007 g / mol; en zuurstof, 15,9994 g / mol.
- Vermenigvuldig elke atomaire massa van een element met het aantal atomen dat in de verbinding aanwezig is.Koolstof: 12.0107 x 6 = 72.0642 g / mol; Waterstof: 1,007 x 12 = 12,084 g / mol; Zuurstof: 15.9994 x 6 = 95.9964 g / mol.
- Het toevoegen van deze producten levert de molaire massa van de verbinding op. 72.0642 + 12.084 + 95.9964 = 180.1446 g / mol. 180,14 gram is de massa van één mol glucose.
-
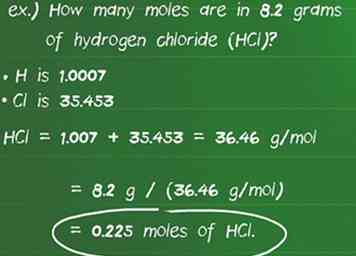 5 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[17][18] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven.
5 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[17][18] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven. - Bijvoorbeeld: Hoeveel mol bevat 8,2 gram waterstofchloride (HCl)?
- De atomaire massa van H is 1.007 en Cl is 35.453 waardoor het molecuulgewicht van de verbinding 1.007 + 35.453 = 36.46 g / mol wordt gemaakt.
- Het verdelen van het aantal grammen van de substantie door de molaire massa levert op: 8,2 g / (36,46 g / mol) = 0,225 mol HC1.
 Minotauromaquia
Minotauromaquia
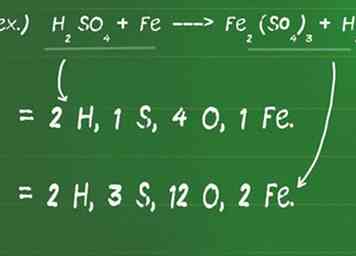 1 Noteer het aantal atomen dat elke verbinding aan weerszijden van de vergelijking bevat. Met behulp van de chemische vergelijking kun je de atomen van elk element in de reactie identificeren. Omdat een chemische reactie nooit nieuwe materie kan creëren of vernietigen, is een gegeven vergelijking onevenwichtig als het aantal (en typen) atomen aan elke kant van de vergelijking niet perfect overeenkomt.
1 Noteer het aantal atomen dat elke verbinding aan weerszijden van de vergelijking bevat. Met behulp van de chemische vergelijking kun je de atomen van elk element in de reactie identificeren. Omdat een chemische reactie nooit nieuwe materie kan creëren of vernietigen, is een gegeven vergelijking onevenwichtig als het aantal (en typen) atomen aan elke kant van de vergelijking niet perfect overeenkomt. 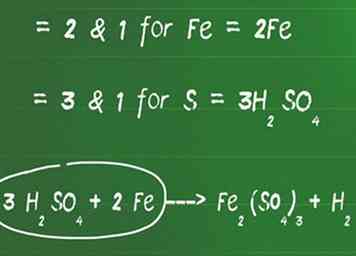 2 Voeg een coëfficiënt toe aan elementen die geen zuurstof en waterstof zijn om elke zijde in balans te brengen. Identificeer de kleinste gemene deler tussen alle elementen die geen zuurstof en waterstof zijn (je zult deze vervolgens in evenwicht brengen) om aan beide kanten evenveel atomen te krijgen.
2 Voeg een coëfficiënt toe aan elementen die geen zuurstof en waterstof zijn om elke zijde in balans te brengen. Identificeer de kleinste gemene deler tussen alle elementen die geen zuurstof en waterstof zijn (je zult deze vervolgens in evenwicht brengen) om aan beide kanten evenveel atomen te krijgen. 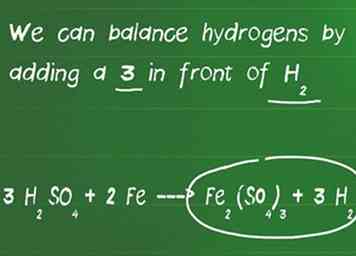 3 Breng de waterstof- en zuurstofatomen in evenwicht. Waterstof- en zuurstofatomen zijn als laatste in balans, omdat ze vaak voorkomen in meerdere moleculen aan elke zijde van de vergelijking. In dit stadium van het in balans brengen van de vergelijking, vergeet niet om de atomen opnieuw te vertellen als je coëfficiënten hebt toegevoegd aan moleculen.
3 Breng de waterstof- en zuurstofatomen in evenwicht. Waterstof- en zuurstofatomen zijn als laatste in balans, omdat ze vaak voorkomen in meerdere moleculen aan elke zijde van de vergelijking. In dit stadium van het in balans brengen van de vergelijking, vergeet niet om de atomen opnieuw te vertellen als je coëfficiënten hebt toegevoegd aan moleculen. 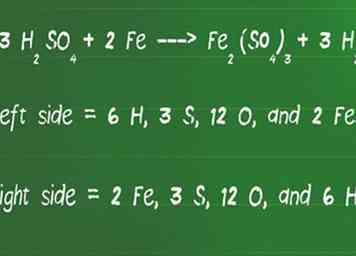 4 Hertel het aantal atomen aan elke kant van de vergelijking om ervoor te zorgen dat ze gelijk zijn. Als je klaar bent, is het slim om terug te gaan en de vergelijking te controleren op balans. Dit kan gedaan worden door opnieuw alle atomen aan weerszijden van de vergelijking bij elkaar op te tellen om ervoor te zorgen dat ze aan beide kanten gelijk zijn.
4 Hertel het aantal atomen aan elke kant van de vergelijking om ervoor te zorgen dat ze gelijk zijn. Als je klaar bent, is het slim om terug te gaan en de vergelijking te controleren op balans. Dit kan gedaan worden door opnieuw alle atomen aan weerszijden van de vergelijking bij elkaar op te tellen om ervoor te zorgen dat ze aan beide kanten gelijk zijn.  1 Bereken de molecuulmassa van de verbinding in gram. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding.[2] Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten.[3] Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in de verbinding bevinden en de atomaire massa van elk element in de verbinding.
1 Bereken de molecuulmassa van de verbinding in gram. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding.[2] Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten.[3] Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in de verbinding bevinden en de atomaire massa van elk element in de verbinding.  2 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[4][5] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven.
2 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[4][5] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven. 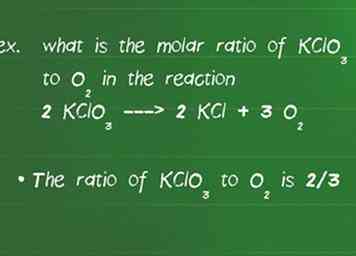 3 Bepaal de molverhouding tussen reactanten. Om de opbrengst van een product in een gegeven reactie te bepalen, moet u de molaire verhouding bepalen.De molverhouding vertelt u de verhouding waarin stoffen met elkaar reageren en wordt gegeven door de coëfficiënt van de soort in de uitgebalanceerde reactie.[6]
3 Bepaal de molverhouding tussen reactanten. Om de opbrengst van een product in een gegeven reactie te bepalen, moet u de molaire verhouding bepalen.De molverhouding vertelt u de verhouding waarin stoffen met elkaar reageren en wordt gegeven door de coëfficiënt van de soort in de uitgebalanceerde reactie.[6]  4 Cross-vermenigvuldigen met de molaire verhouding om mol van andere reactant te vinden. Om het aantal mol van een soort geproduceerd of vereist voor een reactie te berekenen, gebruikt u de molaire verhouding.[8] Bij problemen wordt u meestal gevraagd om het aantal vereiste mol of het aantal mol geproduceerd in een reactie, gegeven een bepaald aantal gram reagens, te bepalen.
4 Cross-vermenigvuldigen met de molaire verhouding om mol van andere reactant te vinden. Om het aantal mol van een soort geproduceerd of vereist voor een reactie te berekenen, gebruikt u de molaire verhouding.[8] Bij problemen wordt u meestal gevraagd om het aantal vereiste mol of het aantal mol geproduceerd in een reactie, gegeven een bepaald aantal gram reagens, te bepalen.  5 Zet mol terug naar massa met behulp van de molecuulmassa van de soort. U zult opnieuw molmassa gebruiken, maar deze keer zult u zich vermenigvuldigen om mollen terug naar gram om te rekenen. Zorg ervoor dat u de molecuulmassa van de juiste soort gebruikt.
5 Zet mol terug naar massa met behulp van de molecuulmassa van de soort. U zult opnieuw molmassa gebruiken, maar deze keer zult u zich vermenigvuldigen om mollen terug naar gram om te rekenen. Zorg ervoor dat u de molecuulmassa van de juiste soort gebruikt.  1 Bepaal of de reactie plaatsvindt bij standaard temperatuur en druk (STP). STP is de verzameling gegeven omstandigheden waarbij 1 mol van een ideaal gas 22,414 liter (L) volume zal innemen.[9] Standaardtemperatuur is 273,15 Kelvin (K) en standaarddruk is 1 atmosfeer (atm).[10]
1 Bepaal of de reactie plaatsvindt bij standaard temperatuur en druk (STP). STP is de verzameling gegeven omstandigheden waarbij 1 mol van een ideaal gas 22,414 liter (L) volume zal innemen.[9] Standaardtemperatuur is 273,15 Kelvin (K) en standaarddruk is 1 atmosfeer (atm).[10]  2 Gebruik de conversiefactor 22.414 L / mol om liters gas om te zetten in mollen. Als uw reactie plaatsvindt bij STP, kunt u 22.414 L / mol gebruiken om het aantal mol in een bepaald volume gas te berekenen.[11] Deel het volume van gas (L) door de conversiefactor om mollen te bepalen.
2 Gebruik de conversiefactor 22.414 L / mol om liters gas om te zetten in mollen. Als uw reactie plaatsvindt bij STP, kunt u 22.414 L / mol gebruiken om het aantal mol in een bepaald volume gas te berekenen.[11] Deel het volume van gas (L) door de conversiefactor om mollen te bepalen.  3 Gebruik de ideale gaswet om liters gas niet bij STP om te zetten. Als u een reactie krijgt die niet bij STP voorkomt, moet u de ideale gaswet PV = nRT gebruiken om het aantal moedervlekken in de reactie te bepalen.[12] P is druk in atmosferen, V is volume in liters, n is het aantal mol, R is de gaswetconstante 0,0821 L-atm / mol-graad en T is de temperatuur in graden Kelvin.[13]
3 Gebruik de ideale gaswet om liters gas niet bij STP om te zetten. Als u een reactie krijgt die niet bij STP voorkomt, moet u de ideale gaswet PV = nRT gebruiken om het aantal moedervlekken in de reactie te bepalen.[12] P is druk in atmosferen, V is volume in liters, n is het aantal mol, R is de gaswetconstante 0,0821 L-atm / mol-graad en T is de temperatuur in graden Kelvin.[13]  1 Bereken de dichtheid van de vloeistof. Soms geven chemische vergelijkingen u het volume van een vloeibaar reagens en vereisen de hoeveelheid gram of aantal mol die nodig is voor de reactie. Om te converteren naar grammen, gebruikt u de dichtheid van die vloeistof. De dichtheid wordt gegeven door massa / volume.[14]
1 Bereken de dichtheid van de vloeistof. Soms geven chemische vergelijkingen u het volume van een vloeibaar reagens en vereisen de hoeveelheid gram of aantal mol die nodig is voor de reactie. Om te converteren naar grammen, gebruikt u de dichtheid van die vloeistof. De dichtheid wordt gegeven door massa / volume.[14]  2 Zet het volume om naar milliliters (ml). Om het volume van vloeistof naar massa (g) om te rekenen, moet je de dichtheid van die vloeistof gebruiken. De dichtheid wordt gegeven in grammen per milliliter (g / ml), daarom moet het volume van de vloeistof in milliliter omgezet worden.
2 Zet het volume om naar milliliters (ml). Om het volume van vloeistof naar massa (g) om te rekenen, moet je de dichtheid van die vloeistof gebruiken. De dichtheid wordt gegeven in grammen per milliliter (g / ml), daarom moet het volume van de vloeistof in milliliter omgezet worden.  3 Vermenigvuldig het volume met de dichtheid. Wanneer u een volume (mL) vermenigvuldigt met de dichtheid van die vloeistof (g / mL), worden de milliliter geannuleerd en blijft er gram van de stof over.[15]
3 Vermenigvuldig het volume met de dichtheid. Wanneer u een volume (mL) vermenigvuldigt met de dichtheid van die vloeistof (g / mL), worden de milliliter geannuleerd en blijft er gram van de stof over.[15] 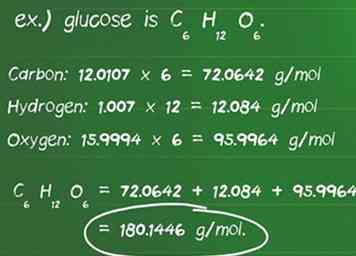 4 Bereken de molaire massa van de reactant. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding. Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten. Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in een verbinding bevinden en de atomaire massa van elk element in de verbinding.
4 Bereken de molaire massa van de reactant. De molmassa is de hoeveelheid in gram (g) van één mol van een verbinding. Hiermee kunt u gemakkelijk grammen en mollen van een stof omzetten. Om de molecuulmassa te berekenen, moet u bepalen hoeveel moleculen van een element zich in een verbinding bevinden en de atomaire massa van elk element in de verbinding. 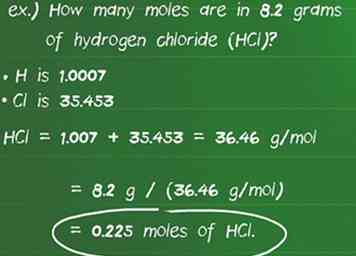 5 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[17][18] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven.
5 Converteer grammen van een stof naar mollen met behulp van molaire massa. Als u de molecuulmassa als een conversiefactor gebruikt, kunt u het aantal aanwezige mollen in het vermelde aantal grammen van de soort berekenen. Deel de bekende hoeveelheid gram (g) door de molecuulmassa (g / mol).[17][18] Een eenvoudige manier om te controleren of je de juiste wiskunde hebt gedaan, is om ervoor te zorgen dat de eenheden worden geannuleerd en alleen mollen blijven.