Je hebt waarschijnlijk onderweg wel geleerd dat water bestaat uit zuurstof en waterstof. In plaats van iemands woord ervoor te nemen, kun je dit aan jezelf bewijzen door het water terug te scheiden in zijn componenten. De meest gebruikelijke techniek om watermoleculen te scheiden, is bekend als elektrolyse. Hoewel elektrolyse kan worden uitgevoerd met huishoudelijke artikelen, bevordert azijnzuur (azijn) de elektrolyse niet voldoende om een merkbare hoeveelheid gas te genereren. Je kunt dit jezelf bewijzen door elektrolyse te doen met azijn, en dan met zuiveringszout. U zult opmerken dat elektrolyse met bakpoeder veel meer gas produceert dan met azijn.
Methode één van de drie:
Het apparaat bouwen
-
 1 Begin met een lege kuip. U kunt een plastic of glazen bad gebruiken. Vermijd het gebruik van een metalen kuip, omdat u een elektrische stroom door het water loopt. De grootte van het bad doet er niet toe, maar een goed uitgangspunt zou zijn om een 1⁄2 gallon (1,9 L) container.[1]
1 Begin met een lege kuip. U kunt een plastic of glazen bad gebruiken. Vermijd het gebruik van een metalen kuip, omdat u een elektrische stroom door het water loopt. De grootte van het bad doet er niet toe, maar een goed uitgangspunt zou zijn om een 1⁄2 gallon (1,9 L) container.[1] -
 2 Tape krokodillenklemmen op de bodem van de kuip. Je hebt 2 krokodillenklemmen nodig. Eén zal verbinding maken met uw positieve elektrode (de anode) en de andere zal verbinding maken met uw negatieve elektrode (de kathode). Tape het ene uiteinde van elke clip aan de binnenkant van de bodem van de kuip. Zorg ervoor dat u voldoende ruimte overlaat, zodat u de clip nog steeds kunt openen en sluiten.[2]
2 Tape krokodillenklemmen op de bodem van de kuip. Je hebt 2 krokodillenklemmen nodig. Eén zal verbinding maken met uw positieve elektrode (de anode) en de andere zal verbinding maken met uw negatieve elektrode (de kathode). Tape het ene uiteinde van elke clip aan de binnenkant van de bodem van de kuip. Zorg ervoor dat u voldoende ruimte overlaat, zodat u de clip nog steeds kunt openen en sluiten.[2] -
 3 Sluit de elektroden aan. U hebt 2 elektroden nodig die gemaakt zijn van een niet-reactief materiaal dat goed elektriciteit geleidt. Een optimale keuze is platina, maar als je geen platina-elektroden hebt die rondslingeren, kun je grafiet gebruiken. Scheer het hout van 2 potloden om 2 grafietstaven te maken. Clip een op elke krokodillenklem in de kuip.
3 Sluit de elektroden aan. U hebt 2 elektroden nodig die gemaakt zijn van een niet-reactief materiaal dat goed elektriciteit geleidt. Een optimale keuze is platina, maar als je geen platina-elektroden hebt die rondslingeren, kun je grafiet gebruiken. Scheer het hout van 2 potloden om 2 grafietstaven te maken. Clip een op elke krokodillenklem in de kuip. - Grafietstaven zijn geweldige elektroden, omdat ze niet oplossen in water en elektriciteit geleiden.
Methode twee van drie:
Elektrolyse van water en azijn
-
 1 Meng een azijnoplossing. Voeg 5 eetlepels (74 ml) azijn toe aan 1⁄2 gallon (1,9 L) water. De resulterende oplossing is enigszins zuur en in staat om een kleine hoeveelheid elektriciteit te geleiden. Giet de oplossing in de kuip.[3]
1 Meng een azijnoplossing. Voeg 5 eetlepels (74 ml) azijn toe aan 1⁄2 gallon (1,9 L) water. De resulterende oplossing is enigszins zuur en in staat om een kleine hoeveelheid elektriciteit te geleiden. Giet de oplossing in de kuip.[3] - U kunt al dan niet de hele oplossing gebruiken. Vul gewoon het bad het grootste deel van de weg.
-
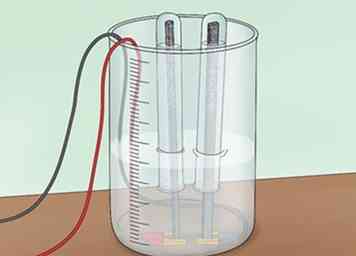 2 Keer een reageerbuis om over elke elektrode. Vul eerst 2 reageerbuisjes met water. Je kunt ze vullen via de kraan of met het water in je badkuip. Keer elke reageerbuis om over een van de grafietelektroden en in het water. Zorg ervoor dat je geen luchtbellen in de reageerbuisjes krijgt. Deze buizen zijn bedoeld om waterstof of zuurstof die wordt gevormd te verzamelen.[4]
2 Keer een reageerbuis om over elke elektrode. Vul eerst 2 reageerbuisjes met water. Je kunt ze vullen via de kraan of met het water in je badkuip. Keer elke reageerbuis om over een van de grafietelektroden en in het water. Zorg ervoor dat je geen luchtbellen in de reageerbuisjes krijgt. Deze buizen zijn bedoeld om waterstof of zuurstof die wordt gevormd te verzamelen.[4] - U moet een klem gebruiken om de reageerbuizen op hun plaats te houden boven de stangen.
-
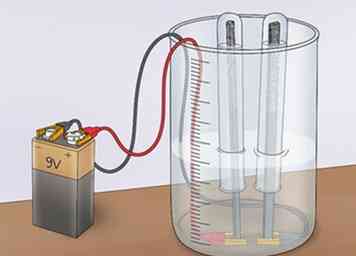 3 Sluit de krokodillenklemmen aan op een voeding. Sluit de krokodillenklemmen (de kant tegenover de elektroden) aan op beide aansluitingen van een 9V-batterij. Hiermee wordt het circuit afgesloten en stroomt er elektriciteit. De stroom zal echter worden beperkt door het onvermogen van de azijnoplossing om goed te geleiden. Dit zal bevestigen dat het azijnzuur in azijn de elektrolyse van water niet bevordert.[5]
3 Sluit de krokodillenklemmen aan op een voeding. Sluit de krokodillenklemmen (de kant tegenover de elektroden) aan op beide aansluitingen van een 9V-batterij. Hiermee wordt het circuit afgesloten en stroomt er elektriciteit. De stroom zal echter worden beperkt door het onvermogen van de azijnoplossing om goed te geleiden. Dit zal bevestigen dat het azijnzuur in azijn de elektrolyse van water niet bevordert.[5] - Deze beperking van de stroom verhindert dat het water wordt gesplitst in waterstof en zuurstof.
- Azijn is een zwak zuur, dus het dissocieert niet volledig wanneer het is opgelost in water, wat betekent dat er minder ionen zijn om elektriciteit te geleiden.
Methode drie van drie:
Electrolyzing Water en Baking Soda
-
 1 Vul de kuip met een natriumbicarbonaatoplossing. Voeg 1 eetlepel (21 g) baking soda (natriumbicarbonaat) toe aan 1⁄2 gallon (1,9 L) water. De zuiveringszout zal oplossen in elektrolyten in de oplossing. Deze elektrolyten zullen de hoeveelheid stroom die het water kan geleiden vergroten. [6]
1 Vul de kuip met een natriumbicarbonaatoplossing. Voeg 1 eetlepel (21 g) baking soda (natriumbicarbonaat) toe aan 1⁄2 gallon (1,9 L) water. De zuiveringszout zal oplossen in elektrolyten in de oplossing. Deze elektrolyten zullen de hoeveelheid stroom die het water kan geleiden vergroten. [6] - Zuiveringszout vormt natrium- en bicarbonaationen wanneer het gedissocieerd is.
-
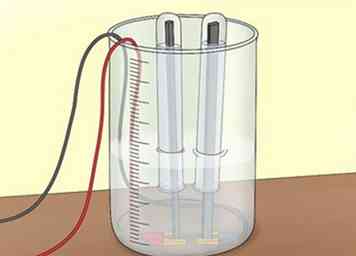 2 Bedek de elektroden. Vul 2 reageerbuisjes met water uit de kraan of uit het bad. Draai elke reageerbuis ondersteboven om elke elektrode te bedekken. Zorg ervoor dat er geen lucht in de reageerbuisjes komt. De buizen verzamelen de gassen die u produceert tijdens de elektrolyse.[7]
2 Bedek de elektroden. Vul 2 reageerbuisjes met water uit de kraan of uit het bad. Draai elke reageerbuis ondersteboven om elke elektrode te bedekken. Zorg ervoor dat er geen lucht in de reageerbuisjes komt. De buizen verzamelen de gassen die u produceert tijdens de elektrolyse.[7] - Gebruik een klem om de reageerbuizen op hun plaats te houden boven de elektroden.
-
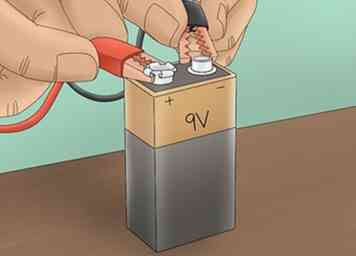 3 Sluit de stroombron aan. Sluit 1 krokodillenklem aan op de pluspool van een 9V-batterij. Verbind de andere met de negatieve pool. Hierdoor wordt een circuit gecreëerd dat stroom door de elektrolytoplossing laat stromen.
3 Sluit de stroombron aan. Sluit 1 krokodillenklem aan op de pluspool van een 9V-batterij. Verbind de andere met de negatieve pool. Hierdoor wordt een circuit gecreëerd dat stroom door de elektrolytoplossing laat stromen. -
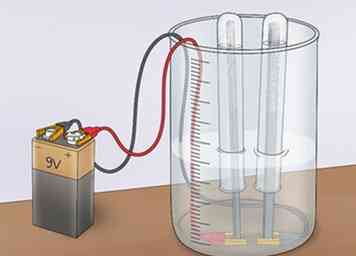 4 Kijk bubbels verzamelen op de anode en kathode. Terwijl de stroom door de oplossing stroomt, zal het een deel van de watermoleculen splitsen. Het resultaat is waterstofgas (H2) en zuurstofgas (O2). Het zuurstofgas, dat een lading van -2 heeft, zal worden aangetrokken door een positieve lading en zal zich verzamelen op de anode (een elektronenacceptor die negatieve ladingen aantrekt, anionen genoemd). Het waterstofgas, dat een lading van +1 heeft, zal worden aangetrokken door een negatieve lading en zal zich verzamelen aan de kathode (een elektronenacceptor die positieve ladingen aantrekt, kationen genaamd).[8]
4 Kijk bubbels verzamelen op de anode en kathode. Terwijl de stroom door de oplossing stroomt, zal het een deel van de watermoleculen splitsen. Het resultaat is waterstofgas (H2) en zuurstofgas (O2). Het zuurstofgas, dat een lading van -2 heeft, zal worden aangetrokken door een positieve lading en zal zich verzamelen op de anode (een elektronenacceptor die negatieve ladingen aantrekt, anionen genoemd). Het waterstofgas, dat een lading van +1 heeft, zal worden aangetrokken door een negatieve lading en zal zich verzamelen aan de kathode (een elektronenacceptor die positieve ladingen aantrekt, kationen genaamd).[8] - Terwijl de gassen zich verzamelen, zullen ze rond hun respectieve elektroden uit het water borrelen en worden gevangen in de reageerbuizen.
- U zult merken dat er water wordt verplaatst aan de bovenkant van de reageerbuis en wordt vervangen door de gassen.
- Merk op dat de buis die de kathode bedekt, tweemaal zoveel water verplaatst als de buis die de anode bedekt. Dit komt omdat er twee keer zoveel waterstofmoleculen worden gevormd als zuurstofmoleculen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Begin met een lege kuip. U kunt een plastic of glazen bad gebruiken. Vermijd het gebruik van een metalen kuip, omdat u een elektrische stroom door het water loopt. De grootte van het bad doet er niet toe, maar een goed uitgangspunt zou zijn om een
1 Begin met een lege kuip. U kunt een plastic of glazen bad gebruiken. Vermijd het gebruik van een metalen kuip, omdat u een elektrische stroom door het water loopt. De grootte van het bad doet er niet toe, maar een goed uitgangspunt zou zijn om een  2 Tape krokodillenklemmen op de bodem van de kuip. Je hebt 2 krokodillenklemmen nodig. Eén zal verbinding maken met uw positieve elektrode (de anode) en de andere zal verbinding maken met uw negatieve elektrode (de kathode). Tape het ene uiteinde van elke clip aan de binnenkant van de bodem van de kuip. Zorg ervoor dat u voldoende ruimte overlaat, zodat u de clip nog steeds kunt openen en sluiten.[2]
2 Tape krokodillenklemmen op de bodem van de kuip. Je hebt 2 krokodillenklemmen nodig. Eén zal verbinding maken met uw positieve elektrode (de anode) en de andere zal verbinding maken met uw negatieve elektrode (de kathode). Tape het ene uiteinde van elke clip aan de binnenkant van de bodem van de kuip. Zorg ervoor dat u voldoende ruimte overlaat, zodat u de clip nog steeds kunt openen en sluiten.[2]  3 Sluit de elektroden aan. U hebt 2 elektroden nodig die gemaakt zijn van een niet-reactief materiaal dat goed elektriciteit geleidt. Een optimale keuze is platina, maar als je geen platina-elektroden hebt die rondslingeren, kun je grafiet gebruiken. Scheer het hout van 2 potloden om 2 grafietstaven te maken. Clip een op elke krokodillenklem in de kuip.
3 Sluit de elektroden aan. U hebt 2 elektroden nodig die gemaakt zijn van een niet-reactief materiaal dat goed elektriciteit geleidt. Een optimale keuze is platina, maar als je geen platina-elektroden hebt die rondslingeren, kun je grafiet gebruiken. Scheer het hout van 2 potloden om 2 grafietstaven te maken. Clip een op elke krokodillenklem in de kuip.  1 Meng een azijnoplossing. Voeg 5 eetlepels (74 ml) azijn toe aan
1 Meng een azijnoplossing. Voeg 5 eetlepels (74 ml) azijn toe aan  2 Keer een reageerbuis om over elke elektrode. Vul eerst 2 reageerbuisjes met water. Je kunt ze vullen via de kraan of met het water in je badkuip. Keer elke reageerbuis om over een van de grafietelektroden en in het water. Zorg ervoor dat je geen luchtbellen in de reageerbuisjes krijgt. Deze buizen zijn bedoeld om waterstof of zuurstof die wordt gevormd te verzamelen.[4]
2 Keer een reageerbuis om over elke elektrode. Vul eerst 2 reageerbuisjes met water. Je kunt ze vullen via de kraan of met het water in je badkuip. Keer elke reageerbuis om over een van de grafietelektroden en in het water. Zorg ervoor dat je geen luchtbellen in de reageerbuisjes krijgt. Deze buizen zijn bedoeld om waterstof of zuurstof die wordt gevormd te verzamelen.[4]  3 Sluit de krokodillenklemmen aan op een voeding. Sluit de krokodillenklemmen (de kant tegenover de elektroden) aan op beide aansluitingen van een 9V-batterij. Hiermee wordt het circuit afgesloten en stroomt er elektriciteit. De stroom zal echter worden beperkt door het onvermogen van de azijnoplossing om goed te geleiden. Dit zal bevestigen dat het azijnzuur in azijn de elektrolyse van water niet bevordert.[5]
3 Sluit de krokodillenklemmen aan op een voeding. Sluit de krokodillenklemmen (de kant tegenover de elektroden) aan op beide aansluitingen van een 9V-batterij. Hiermee wordt het circuit afgesloten en stroomt er elektriciteit. De stroom zal echter worden beperkt door het onvermogen van de azijnoplossing om goed te geleiden. Dit zal bevestigen dat het azijnzuur in azijn de elektrolyse van water niet bevordert.[5]  1 Vul de kuip met een natriumbicarbonaatoplossing. Voeg 1 eetlepel (21 g) baking soda (natriumbicarbonaat) toe aan
1 Vul de kuip met een natriumbicarbonaatoplossing. Voeg 1 eetlepel (21 g) baking soda (natriumbicarbonaat) toe aan  2 Bedek de elektroden. Vul 2 reageerbuisjes met water uit de kraan of uit het bad. Draai elke reageerbuis ondersteboven om elke elektrode te bedekken. Zorg ervoor dat er geen lucht in de reageerbuisjes komt. De buizen verzamelen de gassen die u produceert tijdens de elektrolyse.[7]
2 Bedek de elektroden. Vul 2 reageerbuisjes met water uit de kraan of uit het bad. Draai elke reageerbuis ondersteboven om elke elektrode te bedekken. Zorg ervoor dat er geen lucht in de reageerbuisjes komt. De buizen verzamelen de gassen die u produceert tijdens de elektrolyse.[7]  3 Sluit de stroombron aan. Sluit 1 krokodillenklem aan op de pluspool van een 9V-batterij. Verbind de andere met de negatieve pool. Hierdoor wordt een circuit gecreëerd dat stroom door de elektrolytoplossing laat stromen.
3 Sluit de stroombron aan. Sluit 1 krokodillenklem aan op de pluspool van een 9V-batterij. Verbind de andere met de negatieve pool. Hierdoor wordt een circuit gecreëerd dat stroom door de elektrolytoplossing laat stromen.  4 Kijk bubbels verzamelen op de anode en kathode. Terwijl de stroom door de oplossing stroomt, zal het een deel van de watermoleculen splitsen. Het resultaat is waterstofgas (H2) en zuurstofgas (O2). Het zuurstofgas, dat een lading van -2 heeft, zal worden aangetrokken door een positieve lading en zal zich verzamelen op de anode (een elektronenacceptor die negatieve ladingen aantrekt, anionen genoemd). Het waterstofgas, dat een lading van +1 heeft, zal worden aangetrokken door een negatieve lading en zal zich verzamelen aan de kathode (een elektronenacceptor die positieve ladingen aantrekt, kationen genaamd).[8]
4 Kijk bubbels verzamelen op de anode en kathode. Terwijl de stroom door de oplossing stroomt, zal het een deel van de watermoleculen splitsen. Het resultaat is waterstofgas (H2) en zuurstofgas (O2). Het zuurstofgas, dat een lading van -2 heeft, zal worden aangetrokken door een positieve lading en zal zich verzamelen op de anode (een elektronenacceptor die negatieve ladingen aantrekt, anionen genoemd). Het waterstofgas, dat een lading van +1 heeft, zal worden aangetrokken door een negatieve lading en zal zich verzamelen aan de kathode (een elektronenacceptor die positieve ladingen aantrekt, kationen genaamd).[8]