In de chemie is een molecuul covalente wanneer het wordt gevormd door bindingen tussen niet-metalen.[1] Het benoemen van dit soort verbindingen is meestal een kwestie van de namen van de atomen in het molecuul te kennen, evenals het aantal van elke atoom. Bepaalde speciale regels bestaan voor zuren en verwante verbindingen, die doorgaans worden herkend door de aanwezigheid van een of meer waterstofatomen aan het begin van de formule van de verbinding.
Methode één van de drie:
Numerieke voorvoegsels leren voor Covalent-verbindingen
| Aantal | Grieks voorvoegsel | Voorbeeld |
|---|---|---|
| 1 | Mono- | Koolstof monoxide (CO) |
| 2 | di- | Koolstof dioxide (CO2) |
| 3 | tri- | Fosfor trihydride (PH3) |
| 4 | tetra | Silicium tetrafluoride (SiF4) |
| 5 | penta- | Dinitrogen luifeloxide (N.2O5) |
| 6 | hexa | Zwavel hexachloride (SCl6) |
| 7 | hepta- | Jodium heptafluoride (IF7) |
| 8 | Octa | Tetranitrogen octachloride (N.4cl8) |
Methode twee van drie:
Een naam geven aan Basic Binary Compounds
-
 1 Geef het eerste element in de compound een naam. Moleculaire formules worden gelezen van links naar rechts, net als Engelse woorden. Over het algemeen is het eerste atoom (de 1 aan de linkerkant van de molecuulformule) ook het minst overvloedige atoom in de verbinding. Schrijf eerst de naam van dit atoom.
1 Geef het eerste element in de compound een naam. Moleculaire formules worden gelezen van links naar rechts, net als Engelse woorden. Over het algemeen is het eerste atoom (de 1 aan de linkerkant van de molecuulformule) ook het minst overvloedige atoom in de verbinding. Schrijf eerst de naam van dit atoom. - Bijvoorbeeld in de molecuulformule CF4, Carbon (C) komt eerst, dus we schrijven het eerst: "Koolstof"
- Als je alleen de atomen in het molecuul kent en je de moleculaire formule niet kent, maak je dan geen zorgen. In covalente verbindingen wordt het element dat het eerst voorkomt in deze lijst als eerste geschreven in de moleculaire formule:[3]
-
- B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F
-
- Merk op dat er één uitzondering is: wanneer zuurstof gepaard gaat met een halogeen (een Periode 7-element zoals F, Cl, enz.), Komt het halogeen eerst, zoals in chloormonoxide, dat wordt geschreven als ClO.[4]
-
 2 Schrijf het Griekse voorvoegsel voor het nummer van het tweede atoom. Bekijk vervolgens het tweede atoom in het molecuul. Bepaal hoe vaak het in het molecuul voorkomt. Dit is het getal geschreven in subscript ernaast in de molecuulformule. Als er geen nummer naast het tweede atoom is, wordt het eenmaal weergegeven. Zoek het juiste Griekse voorvoegsel in de bovenstaande tabel en noteer het vervolgens.
2 Schrijf het Griekse voorvoegsel voor het nummer van het tweede atoom. Bekijk vervolgens het tweede atoom in het molecuul. Bepaal hoe vaak het in het molecuul voorkomt. Dit is het getal geschreven in subscript ernaast in de molecuulformule. Als er geen nummer naast het tweede atoom is, wordt het eenmaal weergegeven. Zoek het juiste Griekse voorvoegsel in de bovenstaande tabel en noteer het vervolgens. - In ons voorbeeldelement, CF4, fluor is het tweede element en het verschijnt vier keer. We zullen het Griekse voorvoegsel voor vier schrijven, tetra, vervolgens, als volgt: "Koolstoftetra-"
-
 3 Noem het tweede atoom en eindig het met "-ide." Schrijf nu gewoon de naam van het tweede atoom alsof het een is anion (negatief geladen ion). Met andere woorden, plak gewoon "-ide" aan het einde. In de meeste gevallen moet je een letter of twee van het einde van de naam laten vallen, maar dit is iets dat natuurlijker lijkt naarmate je het meer doet. Bijvoorbeeld, zuurstof wordt "oxide", chloor wordt "chloride", enzovoort.[5]
3 Noem het tweede atoom en eindig het met "-ide." Schrijf nu gewoon de naam van het tweede atoom alsof het een is anion (negatief geladen ion). Met andere woorden, plak gewoon "-ide" aan het einde. In de meeste gevallen moet je een letter of twee van het einde van de naam laten vallen, maar dit is iets dat natuurlijker lijkt naarmate je het meer doet. Bijvoorbeeld, zuurstof wordt "oxide", chloor wordt "chloride", enzovoort.[5] - In ons voorbeeldelement, CF4, fluor is het tweede element, dus we zullen het aan het einde schrijven. Zorg ervoor dat u de -ide-ending toevoegt, zoals dit: "Carbon tetrafluoride".
- Merk op dat het Griekse voorvoegsel en het tweede atoom samen een enkel woord vormen. Ze worden nooit geschreven als 2 afzonderlijke woorden.
-
 4 Voeg aan het begin een Grieks voorvoegsel toe als er meer dan een van de eerste atomen is. Bepaal hoe vaak het eerste atoom in het molecuul verschijnt. Als u de molecuulformule heeft, is dit het getal dat na het eerste atoom in subscript is geschreven. Nogmaals, als er geen nummer is, verschijnt het eerste atoom eenmaal. Als het atoom doet verschijnen meer dan eens, schrijf het Griekse voorvoegsel aan het begin van de naam.
4 Voeg aan het begin een Grieks voorvoegsel toe als er meer dan een van de eerste atomen is. Bepaal hoe vaak het eerste atoom in het molecuul verschijnt. Als u de molecuulformule heeft, is dit het getal dat na het eerste atoom in subscript is geschreven. Nogmaals, als er geen nummer is, verschijnt het eerste atoom eenmaal. Als het atoom doet verschijnen meer dan eens, schrijf het Griekse voorvoegsel aan het begin van de naam. - In ons voorbeeldelement, CF4, koolstof verschijnt eenmaal, dus we hoeven niets te doen. We zouden in het begin niet "mono" schrijven. Je gebruikt alleen "mono" voor het tweede atoom - nooit de eerste. Stikstoftetrachloride zou bijvoorbeeld worden geschreven als N2F4.
-
 5 Voeg alles samen. Gefeliciteerd - je bent klaar. De naam van uw compound is in deze vorm geschreven:
5 Voeg alles samen. Gefeliciteerd - je bent klaar. De naam van uw compound is in deze vorm geschreven: - [Prefix (indien meer dan één)] [Atom 1] gevolgd door [Prefix] [Atom 2 "-ide"]
- We kennen de naam van onze compound al: Koolstoftetrafluoride.
-
 6 Weet dat bepaalde verbindingen uitzonderingen zijn op normale naamgevingsregels. De bovenstaande regels zijn goed voor bijna alle normale binaire covalente moleculen. Een paar geselecteerde moleculen krijgen echter speciale namen die bijna altijd worden gebruikt wanneer ze in wetenschappelijke settings worden besproken. Er is niet echt een manier om deze te voorspellen - je hoeft ze alleen maar te leren. Een paar voorbeelden zijn:[6]
6 Weet dat bepaalde verbindingen uitzonderingen zijn op normale naamgevingsregels. De bovenstaande regels zijn goed voor bijna alle normale binaire covalente moleculen. Een paar geselecteerde moleculen krijgen echter speciale namen die bijna altijd worden gebruikt wanneer ze in wetenschappelijke settings worden besproken. Er is niet echt een manier om deze te voorspellen - je hoeft ze alleen maar te leren. Een paar voorbeelden zijn:[6] - H2O is geen diwaterstofoxide. Haar "water."
- NH3 is geen stikstof trihydride. Haar "Ammonia."
- CH4 is geen koolstoftetrahydride. Haar "Methaan."
Methode drie van drie:
Benoemen van zuren en zuurstofzuren
-
 1 Controleer of het zuur zuurstof bevat. Zuren zijn verbindingen die protonen doneren aan chemische reacties. Vaak beginnen zuren met een of meer H-atomen, hoewel er enkele uitzonderingen zijn.[7] De eerste stap naar het benoemen van een zuur is eenvoudig: controleer eerst of er zuurstof (O) in zit.
1 Controleer of het zuur zuurstof bevat. Zuren zijn verbindingen die protonen doneren aan chemische reacties. Vaak beginnen zuren met een of meer H-atomen, hoewel er enkele uitzonderingen zijn.[7] De eerste stap naar het benoemen van een zuur is eenvoudig: controleer eerst of er zuurstof (O) in zit. - Laten we zeggen dat we bijvoorbeeld werken met de zure HCl. Dit is duidelijk niet zuurstof erin.
-
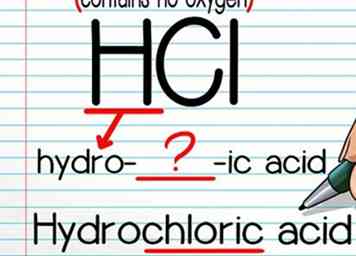 2 Gebruik de formule "hydro- (naam) zuur" als er geen zuurstofatoom is. Het noemen van zuren zonder zuurstofatoom is eenvoudig. Noteer eerst 'hydro-' en vervolgens de naam van het niet-waterstofatoom, en vervolgens '-ic'. Meestal moet je een letter of twee van de naam van het atoom laten vallen om het woord "goed" te laten vloeien - dit is meestal behoorlijk intuïtief. Werk af met het woord "zuur".
2 Gebruik de formule "hydro- (naam) zuur" als er geen zuurstofatoom is. Het noemen van zuren zonder zuurstofatoom is eenvoudig. Noteer eerst 'hydro-' en vervolgens de naam van het niet-waterstofatoom, en vervolgens '-ic'. Meestal moet je een letter of twee van de naam van het atoom laten vallen om het woord "goed" te laten vloeien - dit is meestal behoorlijk intuïtief. Werk af met het woord "zuur". - HCl wordt bijvoorbeeld "zoutzuur."
- Andere voorbeelden omvatten HF (fluorwaterstofzuur) en HI (hydrojoodzuur).
-
 3 Noem eerst het zuurstofanion als er een zuurstofatoom is. Zuren die zuurstof bevatten, zijn een beetje lastiger te noemen. Het is meestal het gemakkelijkst om te beginnen met het benoemen van het zuurstofanion (het deel van het molecuul dat een negatieve lading heeft met de zuurstof erin). Meestal is dit het deel dat is niet de waterstofatomen. Gebruik de onderstaande stappen om zuurstofanionen te noemen:[8]
3 Noem eerst het zuurstofanion als er een zuurstofatoom is. Zuren die zuurstof bevatten, zijn een beetje lastiger te noemen. Het is meestal het gemakkelijkst om te beginnen met het benoemen van het zuurstofanion (het deel van het molecuul dat een negatieve lading heeft met de zuurstof erin). Meestal is dit het deel dat is niet de waterstofatomen. Gebruik de onderstaande stappen om zuurstofanionen te noemen:[8] -
 4 Zoek uit hoeveel anionen zich in dezelfde reeks bevinden als de jouwe. Anionen bevinden zich in dezelfde reeks wanneer u zuurstofatomen kunt toevoegen of aftrekken en de algehele lading op dezelfde manier kunt houden door de oxidatietoestand van het kation (het positief geladen deel van het anion) te veranderen. Een goede gids voor oxidatietoestanden is hier beschikbaar.[9]
4 Zoek uit hoeveel anionen zich in dezelfde reeks bevinden als de jouwe. Anionen bevinden zich in dezelfde reeks wanneer u zuurstofatomen kunt toevoegen of aftrekken en de algehele lading op dezelfde manier kunt houden door de oxidatietoestand van het kation (het positief geladen deel van het anion) te veranderen. Een goede gids voor oxidatietoestanden is hier beschikbaar.[9] - Als er 2 anionen in dezelfde reeks zijn, eindigt de 1 met minder zuurstofatomen met -ite en eindigt de 1 met meer zuurstofatomen met -ate. Bijvoorbeeld SO32- en dus42- beide zijn mogelijk, afhankelijk van of S een oxidatietoestand van 4+ of 6+ heeft. De eerste is sulfiet en de tweede is sulfaat op basis van hun aantal zuurstoffen.
- Als er meer dan twee anionen in dezelfde reeks zijn, gebruik dan het voorvoegsel "hypo" voor de 1 met de minste zuurstof en het voorvoegsel "per-" voor de 1 met de meeste zuurstof. Chloor kan bijvoorbeeld ClO vormen-, ClO2-, ClO3-en ClO4-. Deze zijn genoemd hypochloriet, chloriet, chloraat, en perchloraat respectievelijk.
-
 5 Gebruik de naam van het zuurstofanion om de naam van het zuur te vinden. Nu dat je het zuurstofanion hebt genoemd, is het niet moeilijk om de naam van het zuur zelf te vinden. Gebruik de volgende naamgevingsregels:
5 Gebruik de naam van het zuurstofanion om de naam van het zuur te vinden. Nu dat je het zuurstofanion hebt genoemd, is het niet moeilijk om de naam van het zuur zelf te vinden. Gebruik de volgende naamgevingsregels: - Als het anion eindigt in -ate eindigt het zuur met -ric of -ic.
-
- Voorbeeld: HClO2 is chlorig zuur (van "chlorate", de naam van het zuurstofanion).
-
- Als het anion eindigt in -ite, eindigt het zuur met -ous.
-
- Voorbeeld: HClO3 is chloorzuur (van "chlorite", de naam van het zuurstofanion).
-
- Voeg hypo- of per- toe aan het begin als het anion deze voorvoegsels had.
-
- Voorbeeld: HClO4 is perchloorzuur (van "perchloraat", de naam van het zuurstofanion).
-
- Als het anion eindigt in -ate eindigt het zuur met -ric of -ic.
-
 6 Bepaal zure naamuitzonderingen. Net als bij normale covalente stoffen krijgen bepaalde zuren speciale namen die niet voldoen aan de normale naamgevingsregels. Er is geen gemakkelijke manier om deze te leren, maar ze zijn gemakkelijk te onthouden als je ze tegenkomt. Hieronder enkele voorbeelden:
6 Bepaal zure naamuitzonderingen. Net als bij normale covalente stoffen krijgen bepaalde zuren speciale namen die niet voldoen aan de normale naamgevingsregels. Er is geen gemakkelijke manier om deze te leren, maar ze zijn gemakkelijk te onthouden als je ze tegenkomt. Hieronder enkele voorbeelden: - HCN is "blauwzuur". Hier is geen zuurstof, maar je krijgt nog steeds de naam van de CN-anion - niet de naam van een van beide atomen.
- CH3COOH is "azijnzuur." Technisch gezien wordt deze verbinding genoemd met naamgevingsregels uit de organische chemie, maar deze komen niet in het spel met basale covalente verbindingen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Geef het eerste element in de compound een naam. Moleculaire formules worden gelezen van links naar rechts, net als Engelse woorden. Over het algemeen is het eerste atoom (de 1 aan de linkerkant van de molecuulformule) ook het minst overvloedige atoom in de verbinding. Schrijf eerst de naam van dit atoom.
1 Geef het eerste element in de compound een naam. Moleculaire formules worden gelezen van links naar rechts, net als Engelse woorden. Over het algemeen is het eerste atoom (de 1 aan de linkerkant van de molecuulformule) ook het minst overvloedige atoom in de verbinding. Schrijf eerst de naam van dit atoom.  2 Schrijf het Griekse voorvoegsel voor het nummer van het tweede atoom. Bekijk vervolgens het tweede atoom in het molecuul. Bepaal hoe vaak het in het molecuul voorkomt. Dit is het getal geschreven in subscript ernaast in de molecuulformule. Als er geen nummer naast het tweede atoom is, wordt het eenmaal weergegeven. Zoek het juiste Griekse voorvoegsel in de bovenstaande tabel en noteer het vervolgens.
2 Schrijf het Griekse voorvoegsel voor het nummer van het tweede atoom. Bekijk vervolgens het tweede atoom in het molecuul. Bepaal hoe vaak het in het molecuul voorkomt. Dit is het getal geschreven in subscript ernaast in de molecuulformule. Als er geen nummer naast het tweede atoom is, wordt het eenmaal weergegeven. Zoek het juiste Griekse voorvoegsel in de bovenstaande tabel en noteer het vervolgens.  3 Noem het tweede atoom en eindig het met "-ide." Schrijf nu gewoon de naam van het tweede atoom alsof het een is anion (negatief geladen ion). Met andere woorden, plak gewoon "-ide" aan het einde. In de meeste gevallen moet je een letter of twee van het einde van de naam laten vallen, maar dit is iets dat natuurlijker lijkt naarmate je het meer doet. Bijvoorbeeld, zuurstof wordt "oxide", chloor wordt "chloride", enzovoort.[5]
3 Noem het tweede atoom en eindig het met "-ide." Schrijf nu gewoon de naam van het tweede atoom alsof het een is anion (negatief geladen ion). Met andere woorden, plak gewoon "-ide" aan het einde. In de meeste gevallen moet je een letter of twee van het einde van de naam laten vallen, maar dit is iets dat natuurlijker lijkt naarmate je het meer doet. Bijvoorbeeld, zuurstof wordt "oxide", chloor wordt "chloride", enzovoort.[5]  4 Voeg aan het begin een Grieks voorvoegsel toe als er meer dan een van de eerste atomen is. Bepaal hoe vaak het eerste atoom in het molecuul verschijnt. Als u de molecuulformule heeft, is dit het getal dat na het eerste atoom in subscript is geschreven. Nogmaals, als er geen nummer is, verschijnt het eerste atoom eenmaal. Als het atoom doet verschijnen meer dan eens, schrijf het Griekse voorvoegsel aan het begin van de naam.
4 Voeg aan het begin een Grieks voorvoegsel toe als er meer dan een van de eerste atomen is. Bepaal hoe vaak het eerste atoom in het molecuul verschijnt. Als u de molecuulformule heeft, is dit het getal dat na het eerste atoom in subscript is geschreven. Nogmaals, als er geen nummer is, verschijnt het eerste atoom eenmaal. Als het atoom doet verschijnen meer dan eens, schrijf het Griekse voorvoegsel aan het begin van de naam.  5 Voeg alles samen. Gefeliciteerd - je bent klaar. De naam van uw compound is in deze vorm geschreven:
5 Voeg alles samen. Gefeliciteerd - je bent klaar. De naam van uw compound is in deze vorm geschreven:  6 Weet dat bepaalde verbindingen uitzonderingen zijn op normale naamgevingsregels. De bovenstaande regels zijn goed voor bijna alle normale binaire covalente moleculen. Een paar geselecteerde moleculen krijgen echter speciale namen die bijna altijd worden gebruikt wanneer ze in wetenschappelijke settings worden besproken. Er is niet echt een manier om deze te voorspellen - je hoeft ze alleen maar te leren. Een paar voorbeelden zijn:[6]
6 Weet dat bepaalde verbindingen uitzonderingen zijn op normale naamgevingsregels. De bovenstaande regels zijn goed voor bijna alle normale binaire covalente moleculen. Een paar geselecteerde moleculen krijgen echter speciale namen die bijna altijd worden gebruikt wanneer ze in wetenschappelijke settings worden besproken. Er is niet echt een manier om deze te voorspellen - je hoeft ze alleen maar te leren. Een paar voorbeelden zijn:[6]  1 Controleer of het zuur zuurstof bevat. Zuren zijn verbindingen die protonen doneren aan chemische reacties. Vaak beginnen zuren met een of meer H-atomen, hoewel er enkele uitzonderingen zijn.[7] De eerste stap naar het benoemen van een zuur is eenvoudig: controleer eerst of er zuurstof (O) in zit.
1 Controleer of het zuur zuurstof bevat. Zuren zijn verbindingen die protonen doneren aan chemische reacties. Vaak beginnen zuren met een of meer H-atomen, hoewel er enkele uitzonderingen zijn.[7] De eerste stap naar het benoemen van een zuur is eenvoudig: controleer eerst of er zuurstof (O) in zit.  2 Gebruik de formule "hydro- (naam) zuur" als er geen zuurstofatoom is. Het noemen van zuren zonder zuurstofatoom is eenvoudig. Noteer eerst 'hydro-' en vervolgens de naam van het niet-waterstofatoom, en vervolgens '-ic'. Meestal moet je een letter of twee van de naam van het atoom laten vallen om het woord "goed" te laten vloeien - dit is meestal behoorlijk intuïtief. Werk af met het woord "zuur".
2 Gebruik de formule "hydro- (naam) zuur" als er geen zuurstofatoom is. Het noemen van zuren zonder zuurstofatoom is eenvoudig. Noteer eerst 'hydro-' en vervolgens de naam van het niet-waterstofatoom, en vervolgens '-ic'. Meestal moet je een letter of twee van de naam van het atoom laten vallen om het woord "goed" te laten vloeien - dit is meestal behoorlijk intuïtief. Werk af met het woord "zuur".  3 Noem eerst het zuurstofanion als er een zuurstofatoom is. Zuren die zuurstof bevatten, zijn een beetje lastiger te noemen. Het is meestal het gemakkelijkst om te beginnen met het benoemen van het zuurstofanion (het deel van het molecuul dat een negatieve lading heeft met de zuurstof erin). Meestal is dit het deel dat is niet de waterstofatomen. Gebruik de onderstaande stappen om zuurstofanionen te noemen:[8]
3 Noem eerst het zuurstofanion als er een zuurstofatoom is. Zuren die zuurstof bevatten, zijn een beetje lastiger te noemen. Het is meestal het gemakkelijkst om te beginnen met het benoemen van het zuurstofanion (het deel van het molecuul dat een negatieve lading heeft met de zuurstof erin). Meestal is dit het deel dat is niet de waterstofatomen. Gebruik de onderstaande stappen om zuurstofanionen te noemen:[8]  4 Zoek uit hoeveel anionen zich in dezelfde reeks bevinden als de jouwe. Anionen bevinden zich in dezelfde reeks wanneer u zuurstofatomen kunt toevoegen of aftrekken en de algehele lading op dezelfde manier kunt houden door de oxidatietoestand van het kation (het positief geladen deel van het anion) te veranderen. Een goede gids voor oxidatietoestanden is hier beschikbaar.[9]
4 Zoek uit hoeveel anionen zich in dezelfde reeks bevinden als de jouwe. Anionen bevinden zich in dezelfde reeks wanneer u zuurstofatomen kunt toevoegen of aftrekken en de algehele lading op dezelfde manier kunt houden door de oxidatietoestand van het kation (het positief geladen deel van het anion) te veranderen. Een goede gids voor oxidatietoestanden is hier beschikbaar.[9]  5 Gebruik de naam van het zuurstofanion om de naam van het zuur te vinden. Nu dat je het zuurstofanion hebt genoemd, is het niet moeilijk om de naam van het zuur zelf te vinden. Gebruik de volgende naamgevingsregels:
5 Gebruik de naam van het zuurstofanion om de naam van het zuur te vinden. Nu dat je het zuurstofanion hebt genoemd, is het niet moeilijk om de naam van het zuur zelf te vinden. Gebruik de volgende naamgevingsregels:  6 Bepaal zure naamuitzonderingen. Net als bij normale covalente stoffen krijgen bepaalde zuren speciale namen die niet voldoen aan de normale naamgevingsregels. Er is geen gemakkelijke manier om deze te leren, maar ze zijn gemakkelijk te onthouden als je ze tegenkomt. Hieronder enkele voorbeelden:
6 Bepaal zure naamuitzonderingen. Net als bij normale covalente stoffen krijgen bepaalde zuren speciale namen die niet voldoen aan de normale naamgevingsregels. Er is geen gemakkelijke manier om deze te leren, maar ze zijn gemakkelijk te onthouden als je ze tegenkomt. Hieronder enkele voorbeelden: