Het benoemen van elementaire chemische verbindingen is essentieel als je wilt slagen in de chemie, omdat de naam van de stof duidelijk definieert wat het is. Elk type verbinding heeft zijn eigen regels voor het benoemen ervan. Bij het benoemen van verbindingen moet u deze verschillende regels begrijpen, en ook aanwijzingen vinden om u te helpen de verbindingen op de juiste manier te benoemen. Volg deze handleiding voor enkele basisregels over hoe chemische verbindingen hun naam krijgen en hoe u namen toepast op verbindingen waarmee u niet vertrouwd bent.
Methode één van de drie:
Ionische verbindingen benoemen
-
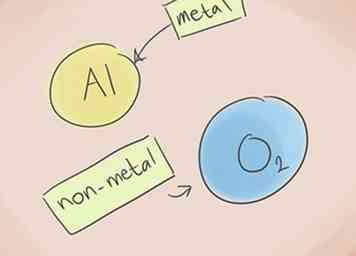 1 Weet wat een verbinding ionisch maakt. Ionische verbindingen bevatten een metaal en een niet-metaal. Raadpleeg het periodiek systeem der elementen om te zien in welke categorieën de elementen in de compound thuishoren.[1]
1 Weet wat een verbinding ionisch maakt. Ionische verbindingen bevatten een metaal en een niet-metaal. Raadpleeg het periodiek systeem der elementen om te zien in welke categorieën de elementen in de compound thuishoren.[1] -
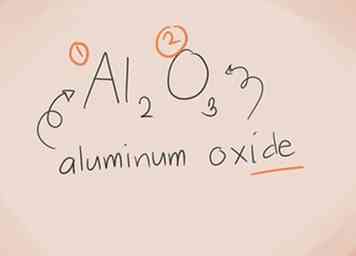 2 Bouw de naam. Voor een uit twee elementen bestaande ionische verbinding is de naamgeving eenvoudig. Het eerste deel van de naam is de naam van het metalen element. Het tweede deel is de naam van het niet-metalen element, met het achtervoegsel "-ide".[2]
2 Bouw de naam. Voor een uit twee elementen bestaande ionische verbinding is de naamgeving eenvoudig. Het eerste deel van de naam is de naam van het metalen element. Het tweede deel is de naam van het niet-metalen element, met het achtervoegsel "-ide".[2] - Hier zijn enkele voorbeelden:
- al2O3. al2 = Aluminium; O3 = Zuurstof. Dus de naam zou "aluminiumoxide" zijn.
- FeCl3. Fe = ijzer; cl3 = Chloor. Dus de naam zou "ijzerchloride" zijn.
- SnO2. Sn = Tin; O2 = Zuurstof. Dus de naam van deze verbinding zou Tin Oxide zijn.
- Hier zijn enkele voorbeelden:
-
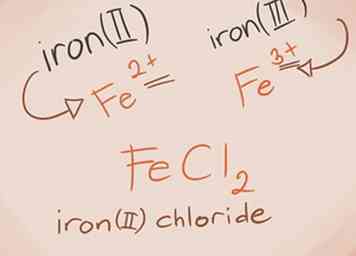 3 Herken overgangsmetalen. Metalen in de D- en F-blokken van het periodiek systeem staan bekend als overgangsmetalen. Hun lading is geschreven met een Romeins cijfer bij het uitschrijven van de samengestelde naam. Dit komt omdat ze meer dan één lading kunnen hebben en meer dan één verbinding kunnen maken.[3]
3 Herken overgangsmetalen. Metalen in de D- en F-blokken van het periodiek systeem staan bekend als overgangsmetalen. Hun lading is geschreven met een Romeins cijfer bij het uitschrijven van de samengestelde naam. Dit komt omdat ze meer dan één lading kunnen hebben en meer dan één verbinding kunnen maken.[3] - Voorbeeld: FeCl2 en FeCl3. Fe = ijzer; cl2 = Chloride -2; cl3 = Chloride -3. De namen zouden ijzer (II) chloride en ijzer (III) chloride zijn.
Methode twee van drie:
Polyatomische verbindingen benoemen
-
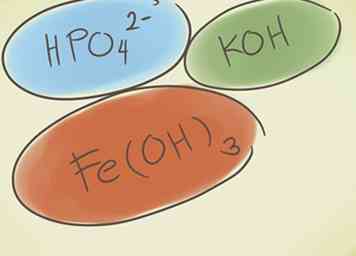 1 Begrijp wat een polyatomische verbinding is. Deze verbindingen zijn opgebouwd uit groepen atomen die covalent aan elkaar zijn gebonden en de hele groep heeft een positieve of negatieve lading.[4] Je kunt drie basisdingen doen voor polyatomaire verbindingen, die je zullen helpen om dit soort verbindingen te identificeren en te begrijpen:
1 Begrijp wat een polyatomische verbinding is. Deze verbindingen zijn opgebouwd uit groepen atomen die covalent aan elkaar zijn gebonden en de hele groep heeft een positieve of negatieve lading.[4] Je kunt drie basisdingen doen voor polyatomaire verbindingen, die je zullen helpen om dit soort verbindingen te identificeren en te begrijpen: - Voeg een waterstof toe aan het begin van de verbinding. Het woord "waterstof" wordt aan het begin van de naam van de stof toegevoegd. Dit vermindert de negatieve lading met één. Bijvoorbeeld, "carbonaat" CO32- wordt "waterstofcarbonaat" HCO3-.

- Verwijder een zuurstof uit de verbinding. De lading blijft hetzelfde en het einde van de verbinding verandert van "-ate" in "-ite". Bijvoorbeeld: NEE3 tot NO2 gaat van "nitraat" naar "nitriet."

- Vervang het centrale atoom door een ander uit dezelfde periodieke groep. Bijvoorbeeld sulfaat SO42- kan Selenate SeO worden42-.
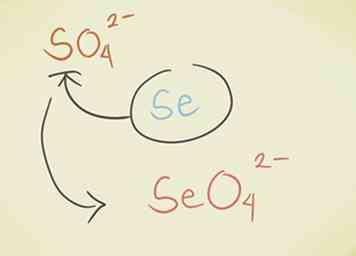
- Voeg een waterstof toe aan het begin van de verbinding. Het woord "waterstof" wordt aan het begin van de naam van de stof toegevoegd. Dit vermindert de negatieve lading met één. Bijvoorbeeld, "carbonaat" CO32- wordt "waterstofcarbonaat" HCO3-.
-
 2 Onthoud de meest voorkomende ionengroepen. Dit zijn de basis voor het vormen van de meeste polyatomaire verbindingen. Vermeld in volgorde van toenemende negatieve lading, ze zijn:
2 Onthoud de meest voorkomende ionengroepen. Dit zijn de basis voor het vormen van de meeste polyatomaire verbindingen. Vermeld in volgorde van toenemende negatieve lading, ze zijn: - Hydroxide-ion: OH-
- Nitraat-ion: NO3-
- Waterstofcarbonaat-ion: HCO3-
- Permanganaat-ion: MnO4-
- Carbonaat-ion: CO32-
- Chromaation: CrO42-
- Dichromaation: Cr2O72-
- Sulfaation: SO42-
- Sulfiet-ion: SO32-
- Thiosulfaation: S2O3<2-
- Fosfaation: PO43-
- Ammoniumion: NH4+
- 3 Maak samengestelde namen op basis van de lijst. Associeer welk element (en) dan ook aan de groepion en naam is gekoppeld. Als het element voor de ionengroep komt, wordt de naam van het element eenvoudig toegevoegd aan het begin van de samengestelde naam.
- Voorbeeld: KMnO4. Je zou de MnO moeten herkennen4- ion als permanganaat. K is kalium, dus de verbinding wordt kaliumpermanganaat genoemd.

- Voorbeeld: NaOH. Je zou de OH moeten herkennen- ion als hydroxide. Na is natrium, dus de verbinding wordt natriumhydroxide genoemd.
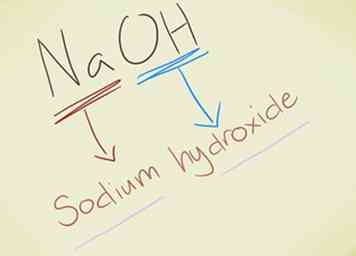
- Voorbeeld: KMnO4. Je zou de MnO moeten herkennen4- ion als permanganaat. K is kalium, dus de verbinding wordt kaliumpermanganaat genoemd.
Methode drie van drie:
Covalente verbindingen noemen
-
 1 Begrijp een covalente verbinding. Covalente verbindingen worden gevormd door twee of meer niet-metalen elementen. De naam voor de stof is gebaseerd op het aantal atomen dat aanwezig is. Het bijgevoegde voorvoegsel is de Latijnse term voor het aantal moleculen.
1 Begrijp een covalente verbinding. Covalente verbindingen worden gevormd door twee of meer niet-metalen elementen. De naam voor de stof is gebaseerd op het aantal atomen dat aanwezig is. Het bijgevoegde voorvoegsel is de Latijnse term voor het aantal moleculen. -
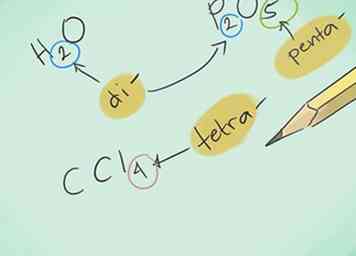 2 Leer de voorvoegsels. Onthoud de prefixen voor maximaal 10 atomen:
2 Leer de voorvoegsels. Onthoud de prefixen voor maximaal 10 atomen: - 1 atoom - "Mono-"
- 2 atomen - "Di-"
- 3 atomen - "Tri-"
- 4 atomen - "Tetra-"
- 5 atomen - "Penta-"
- 6 atomen - "Hexa-"
- 7 atomen - "Hepta-"
- 8 atomen - "Octa-"
- 9 atomen - "Nona-"
- 10 atomen - "Deca-"
- 3 Geef de verbindingen een naam. Gebruik de juiste prefixen en noem de nieuwe verbinding. U voegt voorvoegsels toe aan elk deel van de verbinding met meerdere atomen.
- Voorbeeld: CO zou koolmonoxide en CO zijn2 zou koolstofdioxide zijn.

- Voorbeeld: N2S3 zou Dinitrogen trisulfide zijn.
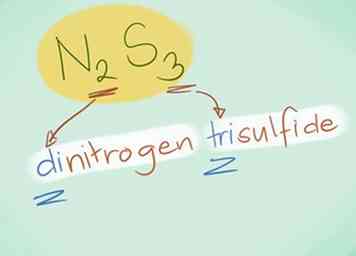
- In de meeste gevallen kan het "mono-" voorvoegsel worden weggelaten, omdat het wordt geïmpliceerd als het niet aanwezig is. Het wordt nog steeds gebruikt voor koolmonoxide vanwege de term in gebruik sinds de vroege chemie.

- Voorbeeld: CO zou koolmonoxide en CO zijn2 zou koolstofdioxide zijn.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Weet wat een verbinding ionisch maakt. Ionische verbindingen bevatten een metaal en een niet-metaal. Raadpleeg het periodiek systeem der elementen om te zien in welke categorieën de elementen in de compound thuishoren.[1]
1 Weet wat een verbinding ionisch maakt. Ionische verbindingen bevatten een metaal en een niet-metaal. Raadpleeg het periodiek systeem der elementen om te zien in welke categorieën de elementen in de compound thuishoren.[1] 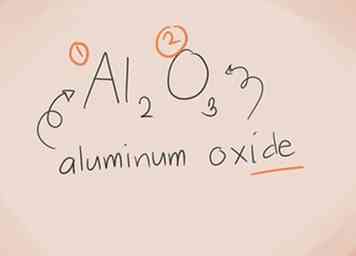 2 Bouw de naam. Voor een uit twee elementen bestaande ionische verbinding is de naamgeving eenvoudig. Het eerste deel van de naam is de naam van het metalen element. Het tweede deel is de naam van het niet-metalen element, met het achtervoegsel "-ide".[2]
2 Bouw de naam. Voor een uit twee elementen bestaande ionische verbinding is de naamgeving eenvoudig. Het eerste deel van de naam is de naam van het metalen element. Het tweede deel is de naam van het niet-metalen element, met het achtervoegsel "-ide".[2] 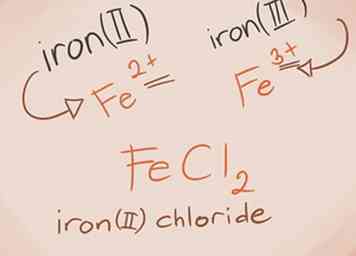 3 Herken overgangsmetalen. Metalen in de D- en F-blokken van het periodiek systeem staan bekend als overgangsmetalen. Hun lading is geschreven met een Romeins cijfer bij het uitschrijven van de samengestelde naam. Dit komt omdat ze meer dan één lading kunnen hebben en meer dan één verbinding kunnen maken.[3]
3 Herken overgangsmetalen. Metalen in de D- en F-blokken van het periodiek systeem staan bekend als overgangsmetalen. Hun lading is geschreven met een Romeins cijfer bij het uitschrijven van de samengestelde naam. Dit komt omdat ze meer dan één lading kunnen hebben en meer dan één verbinding kunnen maken.[3]  1 Begrijp wat een polyatomische verbinding is. Deze verbindingen zijn opgebouwd uit groepen atomen die covalent aan elkaar zijn gebonden en de hele groep heeft een positieve of negatieve lading.[4] Je kunt drie basisdingen doen voor polyatomaire verbindingen, die je zullen helpen om dit soort verbindingen te identificeren en te begrijpen:
1 Begrijp wat een polyatomische verbinding is. Deze verbindingen zijn opgebouwd uit groepen atomen die covalent aan elkaar zijn gebonden en de hele groep heeft een positieve of negatieve lading.[4] Je kunt drie basisdingen doen voor polyatomaire verbindingen, die je zullen helpen om dit soort verbindingen te identificeren en te begrijpen: 


 2 Onthoud de meest voorkomende ionengroepen. Dit zijn de basis voor het vormen van de meeste polyatomaire verbindingen. Vermeld in volgorde van toenemende negatieve lading, ze zijn:
2 Onthoud de meest voorkomende ionengroepen. Dit zijn de basis voor het vormen van de meeste polyatomaire verbindingen. Vermeld in volgorde van toenemende negatieve lading, ze zijn: 

 1 Begrijp een covalente verbinding. Covalente verbindingen worden gevormd door twee of meer niet-metalen elementen. De naam voor de stof is gebaseerd op het aantal atomen dat aanwezig is. Het bijgevoegde voorvoegsel is de Latijnse term voor het aantal moleculen.
1 Begrijp een covalente verbinding. Covalente verbindingen worden gevormd door twee of meer niet-metalen elementen. De naam voor de stof is gebaseerd op het aantal atomen dat aanwezig is. Het bijgevoegde voorvoegsel is de Latijnse term voor het aantal moleculen.  2 Leer de voorvoegsels. Onthoud de prefixen voor maximaal 10 atomen:
2 Leer de voorvoegsels. Onthoud de prefixen voor maximaal 10 atomen: 

