Dichtheid wordt gedefinieerd als de hoeveelheid massa die aanwezig is in een bepaald volume. Voor vaste stoffen en vloeistoffen is dit een redelijk eenvoudige meting. Gassen reageren echter bijzonder goed op temperatuur en druk (meer dan vaste stoffen of vloeistoffen), waardoor hun dichtheid vrij snel kan veranderen. Als u de dichtheid experimenteel bepaalt, moet u rekening houden met deze temperatuur- en drukgevoeligheid. Als u van plan bent de theoretische dichtheid van een gas te vinden, moet u de Ideale gaswet gebruiken om rekening te houden met alle variabelen.
Methode één van de drie:
Het experimenteel bepalen van de dichtheid van gassen
-
 1 Vul een ballon. Een ballon is ontworpen om te worden opgeblazen door gas, waardoor het het perfecte vat is om een vaste hoeveelheid gas op te slaan. Je kunt de ballon vullen met lucht met behulp van een pomp, of je kunt een ander type gas kiezen, zoals helium of stikstof. Zodra de ballon is gevuld, bind het einde zodat er geen gas ontsnapt.[1]
1 Vul een ballon. Een ballon is ontworpen om te worden opgeblazen door gas, waardoor het het perfecte vat is om een vaste hoeveelheid gas op te slaan. Je kunt de ballon vullen met lucht met behulp van een pomp, of je kunt een ander type gas kiezen, zoals helium of stikstof. Zodra de ballon is gevuld, bind het einde zodat er geen gas ontsnapt.[1] -
 2 Dompel de ballon volledig onder in een transparante container. Dompel de ballon vervolgens onder in een bak met water. De ballon zal het waterniveau doen stijgen. Markeer de nieuwe hoogte van het water en verwijder de ballon.[2]
2 Dompel de ballon volledig onder in een transparante container. Dompel de ballon vervolgens onder in een bak met water. De ballon zal het waterniveau doen stijgen. Markeer de nieuwe hoogte van het water en verwijder de ballon.[2] -
 3 Meet de hoeveelheid verplaatst water. Gebruik een meetinstrument (bijvoorbeeld een beker of beker) om de hoeveelheid water te meten die nodig is om de container tot het merkteken te vullen (zonder de ballon in het water). Giet langzaam. Als je te veel giet, moet je opnieuw beginnen. Het volume van de ballon is gelijk aan het volume van het water dat u toevoegt. Noteer deze waarde voor later gebruik als V.[3]
3 Meet de hoeveelheid verplaatst water. Gebruik een meetinstrument (bijvoorbeeld een beker of beker) om de hoeveelheid water te meten die nodig is om de container tot het merkteken te vullen (zonder de ballon in het water). Giet langzaam. Als je te veel giet, moet je opnieuw beginnen. Het volume van de ballon is gelijk aan het volume van het water dat u toevoegt. Noteer deze waarde voor later gebruik als V.[3] - U kunt tijd besparen door de ballon onder te dompelen in een grote beker of een andere vooraf afgemeten container. Dan kun je overslaan met het toevoegen van water overslaan en simpelweg het volume van het water aftrekken van het volume van het water en de ballon.
-
 4 Weeg de met gas gevulde ballon. U kunt de ballon wegen met een gevoelige schaal. Elektrische weegschalen zijn meestal het beste voor deze toepassing. Noteer het gewicht van de met gas gevulde ballon voor later gebruik als mGB.[4]
4 Weeg de met gas gevulde ballon. U kunt de ballon wegen met een gevoelige schaal. Elektrische weegschalen zijn meestal het beste voor deze toepassing. Noteer het gewicht van de met gas gevulde ballon voor later gebruik als mGB.[4] - Als u de ballon vult met een gas dat lichter is dan lucht, moet u de take wegen voordat en nadat u de ballon hebt gevuld om de hoeveelheid gebruikt gas te bepalen.
-
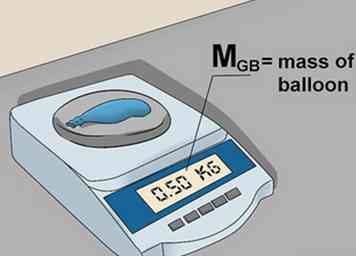 5 Zoek de massa van de lege ballon. Steek een gat in de ballon. Hierdoor kan het gas ontsnappen. Weeg de ballon opnieuw en noteer het gewicht van de lege ballon als mB.[5]
5 Zoek de massa van de lege ballon. Steek een gat in de ballon. Hierdoor kan het gas ontsnappen. Weeg de ballon opnieuw en noteer het gewicht van de lege ballon als mB.[5] -
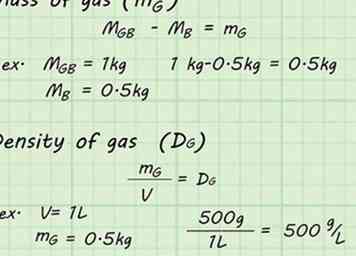 6 Doe de berekeningen. Nu u voldoende gegevens hebt, kunt u de dichtheid van het gas in de ballon berekenen. Trek het gewicht van de lege ballon af, mB, vanaf het gewicht van de volle ballon, mGB. Dit geeft je de massa van het gas alleen, mG. Verdeel de massa van het gas, mG, door het volume, V, van het gas om de dichtheid van het gas te vinden, DG.[6]
6 Doe de berekeningen. Nu u voldoende gegevens hebt, kunt u de dichtheid van het gas in de ballon berekenen. Trek het gewicht van de lege ballon af, mB, vanaf het gewicht van de volle ballon, mGB. Dit geeft je de massa van het gas alleen, mG. Verdeel de massa van het gas, mG, door het volume, V, van het gas om de dichtheid van het gas te vinden, DG.[6] - mGB - mB = mG
- Als de volledige ballon bijvoorbeeld een massa van 1 kg had en de lege ballon een massa van 0,5 kg had, dan was de massa van het gas (mG) zou worden gevonden door: 1 kg - 0,5 kg = 0,5 kg.
- mG / V = DG
- Als de ballon bijvoorbeeld 1 L water verplaatst, kan de dichtheid worden vastgesteld door de massa te delen door dat volume: 500 g / 1 L = 500 g / L
- mGB - mB = mG
Methode twee van drie:
De theoretische dichtheid van een gas vinden
-
 1 Begrijp de ideale gaswet. U moet weten dat de Ideale gaswet een theoretisch hulpmiddel is dat het gedrag van gassen onder specifieke omstandigheden regelt. U kunt het samenvatten in de vergelijking PV = nRT. Dit betekent eenvoudigweg dat druk (P) vermenigvuldigd met volume (V) gelijk is aan het aantal mol (n) maal de ideale gasconstante (R) maal de absolute temperatuur (T) voor een ideaal gas. [7]
1 Begrijp de ideale gaswet. U moet weten dat de Ideale gaswet een theoretisch hulpmiddel is dat het gedrag van gassen onder specifieke omstandigheden regelt. U kunt het samenvatten in de vergelijking PV = nRT. Dit betekent eenvoudigweg dat druk (P) vermenigvuldigd met volume (V) gelijk is aan het aantal mol (n) maal de ideale gasconstante (R) maal de absolute temperatuur (T) voor een ideaal gas. [7] - Een mol (n) is gelijk aan 6.022 * 10 ^ 23 moleculen gas.
- De ideale gasconstante (R) is 0,0821 L · atm / mol · K.
- De absolute temperatuur wordt gemeten in Kelvins (K).
-
 2 Ga uit van standaardtemperatuur en -druk. Standaardtemperatuur en -druk, of STP, is gedefinieerd als 273 K (32 ° F) (0 ° C) en 1 standaardatmosfeer (1,0 bar). Ervan uitgaande dat STP u toelaat om het volume van 1 mol van een willekeurig gas te berekenen op 22,414 liter. Het kennen van dit volume zal absoluut noodzakelijk zijn om de dichtheid van uw gas te vinden.[8]
2 Ga uit van standaardtemperatuur en -druk. Standaardtemperatuur en -druk, of STP, is gedefinieerd als 273 K (32 ° F) (0 ° C) en 1 standaardatmosfeer (1,0 bar). Ervan uitgaande dat STP u toelaat om het volume van 1 mol van een willekeurig gas te berekenen op 22,414 liter. Het kennen van dit volume zal absoluut noodzakelijk zijn om de dichtheid van uw gas te vinden.[8] -
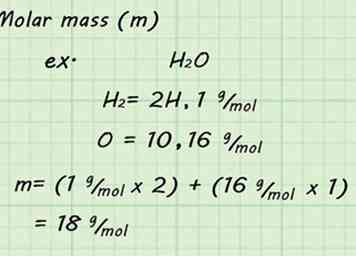 3 Zoek de molecuulmassa van het gas. Aangezien u STP gebruikt en uitgaat van één mol gas, zal het vinden van de molecuulmassa eenvoudig zijn. Voeg de molaire massa toe van alle individuele atomen waaruit je gas maakt om de molecuulmassa van het gas te vinden. De atoommassa's zijn te vinden op het periodiek systeem.[9]
3 Zoek de molecuulmassa van het gas. Aangezien u STP gebruikt en uitgaat van één mol gas, zal het vinden van de molecuulmassa eenvoudig zijn. Voeg de molaire massa toe van alle individuele atomen waaruit je gas maakt om de molecuulmassa van het gas te vinden. De atoommassa's zijn te vinden op het periodiek systeem.[9] - Bijvoorbeeld het vinden van de molecuulmassa van H2O gas zou betekenen dat de massa's van 2 waterstoffen en 1 zuurstof worden toegevoegd. De resulterende molaire massa zou 18 g / mol (1 g / mol + 1 g / mol + 16 g / mol) zijn.
-
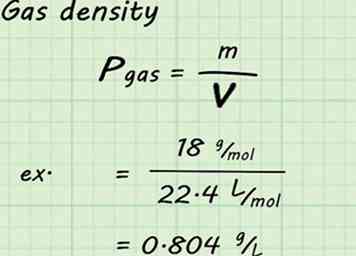 4 Bereken de dichtheid van het gas. Hoewel het volume en het aantal mol gas in deze berekeningen zijn vastgelegd, is de molecuulmassa verschillend voor elk gas. Dat betekent dat de dichtheid ook voor elk gas anders zal zijn. Om een gegeven gasdichtheid te vinden, verdeel de molaire massa van het gas door het molaire volume (in dit geval 22,4 L / mol).[10]
4 Bereken de dichtheid van het gas. Hoewel het volume en het aantal mol gas in deze berekeningen zijn vastgelegd, is de molecuulmassa verschillend voor elk gas. Dat betekent dat de dichtheid ook voor elk gas anders zal zijn. Om een gegeven gasdichtheid te vinden, verdeel de molaire massa van het gas door het molaire volume (in dit geval 22,4 L / mol).[10] - Als u bijvoorbeeld de dichtheid van waterdamp zoekt, deelt u 18 g / mol door 22,4 L / mol om 0,804 g / L te verkrijgen. Dat wil zeggen: 18 g / mol / 22,4 L / mol = 0,804 g / L.
Methode drie van drie:
De theoretische dichtheid van een gasmengsel vinden
-
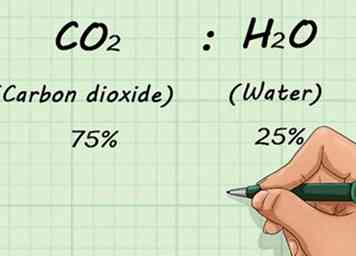 1 Ken de fractionele afbraak van het gasmengsel. Als u twee of meer gassen hebt gemengd, moet u weten hoeveel van elk gas aanwezig is. Dit gebeurt op een percentage basis. Hiermee kunt u de verhoudingen van het mengsel bepalen, ongeacht hoeveel gas er in totaal aanwezig is.[11]
1 Ken de fractionele afbraak van het gasmengsel. Als u twee of meer gassen hebt gemengd, moet u weten hoeveel van elk gas aanwezig is. Dit gebeurt op een percentage basis. Hiermee kunt u de verhoudingen van het mengsel bepalen, ongeacht hoeveel gas er in totaal aanwezig is.[11] - Als u bijvoorbeeld een mengsel van 75% CO had2 (koolstofdioxide) en 25% H2O (water), die verhoudingen zouden niet veranderen, of je nu 1 L of 1.000 L gas hebt.
-
 2 Zoek de massa van één mol. Door de verhouding van uw gassen te kennen, kunt u de molecuulmassa van uw mengsel vinden. Je zult de molaire massa van elk gas moeten vinden en het vermenigvuldigen met het percentage samenstelling in het mengsel. Voeg vervolgens alle producten bij elkaar om de molecuulmassa van het gasmengsel te vinden.[12]
2 Zoek de massa van één mol. Door de verhouding van uw gassen te kennen, kunt u de molecuulmassa van uw mengsel vinden. Je zult de molaire massa van elk gas moeten vinden en het vermenigvuldigen met het percentage samenstelling in het mengsel. Voeg vervolgens alle producten bij elkaar om de molecuulmassa van het gasmengsel te vinden.[12] - U zou bijvoorbeeld de molecuulmassa van CO kunnen vinden2 (44 g / mol) en vermenigvuldig dit met 0,75. Vervolgens zou je de molecuulmassa van H vinden2O (18 g / mol) en vermenigvuldig dit met 0,25. Als u deze producten bij elkaar voegt, 33 g / mol + 4,5 g / mol, geeft u de molecuulmassa van uw mengsel op. In dit geval is de molmassa 37,5 g / mol.
-
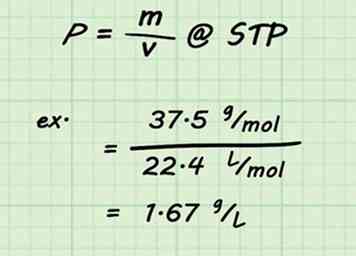 3 Deel door het volume. Zodra de molecuulmassa voor uw mengsel is vastgesteld, is het vinden van de dichtheid van het gas een eenvoudige berekening. Verdeel de molecuulmassa door het standaardvolume (22,4 L / mol). Vergeet niet dat u STP en 1 mol gas aanneemt.[13]
3 Deel door het volume. Zodra de molecuulmassa voor uw mengsel is vastgesteld, is het vinden van de dichtheid van het gas een eenvoudige berekening. Verdeel de molecuulmassa door het standaardvolume (22,4 L / mol). Vergeet niet dat u STP en 1 mol gas aanneemt.[13] - Bijvoorbeeld, de dichtheid van een mengsel van 75% koolstofdioxide en 25% water zou zijn .
- U moet de formule Ideal Gas Law toepassen voor uw berekeningen als het gas zich niet op STP (PV = nRT) bevindt.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Vul een ballon. Een ballon is ontworpen om te worden opgeblazen door gas, waardoor het het perfecte vat is om een vaste hoeveelheid gas op te slaan. Je kunt de ballon vullen met lucht met behulp van een pomp, of je kunt een ander type gas kiezen, zoals helium of stikstof. Zodra de ballon is gevuld, bind het einde zodat er geen gas ontsnapt.[1]
1 Vul een ballon. Een ballon is ontworpen om te worden opgeblazen door gas, waardoor het het perfecte vat is om een vaste hoeveelheid gas op te slaan. Je kunt de ballon vullen met lucht met behulp van een pomp, of je kunt een ander type gas kiezen, zoals helium of stikstof. Zodra de ballon is gevuld, bind het einde zodat er geen gas ontsnapt.[1]  2 Dompel de ballon volledig onder in een transparante container. Dompel de ballon vervolgens onder in een bak met water. De ballon zal het waterniveau doen stijgen. Markeer de nieuwe hoogte van het water en verwijder de ballon.[2]
2 Dompel de ballon volledig onder in een transparante container. Dompel de ballon vervolgens onder in een bak met water. De ballon zal het waterniveau doen stijgen. Markeer de nieuwe hoogte van het water en verwijder de ballon.[2]  3 Meet de hoeveelheid verplaatst water. Gebruik een meetinstrument (bijvoorbeeld een beker of beker) om de hoeveelheid water te meten die nodig is om de container tot het merkteken te vullen (zonder de ballon in het water). Giet langzaam. Als je te veel giet, moet je opnieuw beginnen. Het volume van de ballon is gelijk aan het volume van het water dat u toevoegt. Noteer deze waarde voor later gebruik als V.[3]
3 Meet de hoeveelheid verplaatst water. Gebruik een meetinstrument (bijvoorbeeld een beker of beker) om de hoeveelheid water te meten die nodig is om de container tot het merkteken te vullen (zonder de ballon in het water). Giet langzaam. Als je te veel giet, moet je opnieuw beginnen. Het volume van de ballon is gelijk aan het volume van het water dat u toevoegt. Noteer deze waarde voor later gebruik als V.[3]  4 Weeg de met gas gevulde ballon. U kunt de ballon wegen met een gevoelige schaal. Elektrische weegschalen zijn meestal het beste voor deze toepassing. Noteer het gewicht van de met gas gevulde ballon voor later gebruik als mGB.[4]
4 Weeg de met gas gevulde ballon. U kunt de ballon wegen met een gevoelige schaal. Elektrische weegschalen zijn meestal het beste voor deze toepassing. Noteer het gewicht van de met gas gevulde ballon voor later gebruik als mGB.[4]  5 Zoek de massa van de lege ballon. Steek een gat in de ballon. Hierdoor kan het gas ontsnappen. Weeg de ballon opnieuw en noteer het gewicht van de lege ballon als mB.[5]
5 Zoek de massa van de lege ballon. Steek een gat in de ballon. Hierdoor kan het gas ontsnappen. Weeg de ballon opnieuw en noteer het gewicht van de lege ballon als mB.[5] 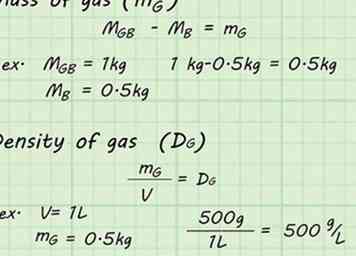 6 Doe de berekeningen. Nu u voldoende gegevens hebt, kunt u de dichtheid van het gas in de ballon berekenen. Trek het gewicht van de lege ballon af, mB, vanaf het gewicht van de volle ballon, mGB. Dit geeft je de massa van het gas alleen, mG. Verdeel de massa van het gas, mG, door het volume, V, van het gas om de dichtheid van het gas te vinden, DG.[6]
6 Doe de berekeningen. Nu u voldoende gegevens hebt, kunt u de dichtheid van het gas in de ballon berekenen. Trek het gewicht van de lege ballon af, mB, vanaf het gewicht van de volle ballon, mGB. Dit geeft je de massa van het gas alleen, mG. Verdeel de massa van het gas, mG, door het volume, V, van het gas om de dichtheid van het gas te vinden, DG.[6]  1 Begrijp de ideale gaswet. U moet weten dat de Ideale gaswet een theoretisch hulpmiddel is dat het gedrag van gassen onder specifieke omstandigheden regelt. U kunt het samenvatten in de vergelijking PV = nRT. Dit betekent eenvoudigweg dat druk (P) vermenigvuldigd met volume (V) gelijk is aan het aantal mol (n) maal de ideale gasconstante (R) maal de absolute temperatuur (T) voor een ideaal gas. [7]
1 Begrijp de ideale gaswet. U moet weten dat de Ideale gaswet een theoretisch hulpmiddel is dat het gedrag van gassen onder specifieke omstandigheden regelt. U kunt het samenvatten in de vergelijking PV = nRT. Dit betekent eenvoudigweg dat druk (P) vermenigvuldigd met volume (V) gelijk is aan het aantal mol (n) maal de ideale gasconstante (R) maal de absolute temperatuur (T) voor een ideaal gas. [7]  2 Ga uit van standaardtemperatuur en -druk. Standaardtemperatuur en -druk, of STP, is gedefinieerd als 273 K (32 ° F) (0 ° C) en 1 standaardatmosfeer (1,0 bar). Ervan uitgaande dat STP u toelaat om het volume van 1 mol van een willekeurig gas te berekenen op 22,414 liter. Het kennen van dit volume zal absoluut noodzakelijk zijn om de dichtheid van uw gas te vinden.[8]
2 Ga uit van standaardtemperatuur en -druk. Standaardtemperatuur en -druk, of STP, is gedefinieerd als 273 K (32 ° F) (0 ° C) en 1 standaardatmosfeer (1,0 bar). Ervan uitgaande dat STP u toelaat om het volume van 1 mol van een willekeurig gas te berekenen op 22,414 liter. Het kennen van dit volume zal absoluut noodzakelijk zijn om de dichtheid van uw gas te vinden.[8] 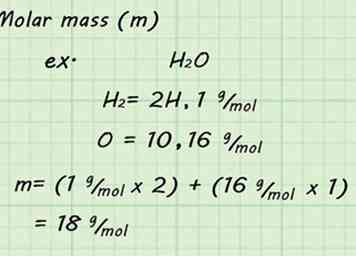 3 Zoek de molecuulmassa van het gas. Aangezien u STP gebruikt en uitgaat van één mol gas, zal het vinden van de molecuulmassa eenvoudig zijn. Voeg de molaire massa toe van alle individuele atomen waaruit je gas maakt om de molecuulmassa van het gas te vinden. De atoommassa's zijn te vinden op het periodiek systeem.[9]
3 Zoek de molecuulmassa van het gas. Aangezien u STP gebruikt en uitgaat van één mol gas, zal het vinden van de molecuulmassa eenvoudig zijn. Voeg de molaire massa toe van alle individuele atomen waaruit je gas maakt om de molecuulmassa van het gas te vinden. De atoommassa's zijn te vinden op het periodiek systeem.[9] 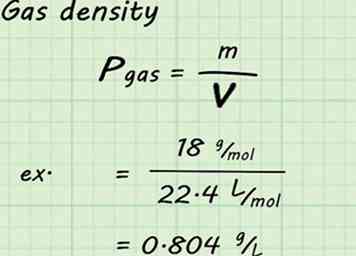 4 Bereken de dichtheid van het gas. Hoewel het volume en het aantal mol gas in deze berekeningen zijn vastgelegd, is de molecuulmassa verschillend voor elk gas. Dat betekent dat de dichtheid ook voor elk gas anders zal zijn. Om een gegeven gasdichtheid te vinden, verdeel de molaire massa van het gas door het molaire volume (in dit geval 22,4 L / mol).[10]
4 Bereken de dichtheid van het gas. Hoewel het volume en het aantal mol gas in deze berekeningen zijn vastgelegd, is de molecuulmassa verschillend voor elk gas. Dat betekent dat de dichtheid ook voor elk gas anders zal zijn. Om een gegeven gasdichtheid te vinden, verdeel de molaire massa van het gas door het molaire volume (in dit geval 22,4 L / mol).[10] 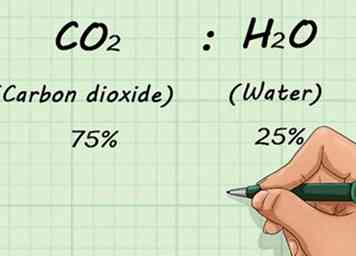 1 Ken de fractionele afbraak van het gasmengsel. Als u twee of meer gassen hebt gemengd, moet u weten hoeveel van elk gas aanwezig is. Dit gebeurt op een percentage basis. Hiermee kunt u de verhoudingen van het mengsel bepalen, ongeacht hoeveel gas er in totaal aanwezig is.[11]
1 Ken de fractionele afbraak van het gasmengsel. Als u twee of meer gassen hebt gemengd, moet u weten hoeveel van elk gas aanwezig is. Dit gebeurt op een percentage basis. Hiermee kunt u de verhoudingen van het mengsel bepalen, ongeacht hoeveel gas er in totaal aanwezig is.[11]  2 Zoek de massa van één mol. Door de verhouding van uw gassen te kennen, kunt u de molecuulmassa van uw mengsel vinden. Je zult de molaire massa van elk gas moeten vinden en het vermenigvuldigen met het percentage samenstelling in het mengsel. Voeg vervolgens alle producten bij elkaar om de molecuulmassa van het gasmengsel te vinden.[12]
2 Zoek de massa van één mol. Door de verhouding van uw gassen te kennen, kunt u de molecuulmassa van uw mengsel vinden. Je zult de molaire massa van elk gas moeten vinden en het vermenigvuldigen met het percentage samenstelling in het mengsel. Voeg vervolgens alle producten bij elkaar om de molecuulmassa van het gasmengsel te vinden.[12] 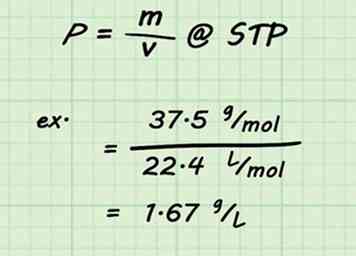 3 Deel door het volume. Zodra de molecuulmassa voor uw mengsel is vastgesteld, is het vinden van de dichtheid van het gas een eenvoudige berekening. Verdeel de molecuulmassa door het standaardvolume (22,4 L / mol). Vergeet niet dat u STP en 1 mol gas aanneemt.[13]
3 Deel door het volume. Zodra de molecuulmassa voor uw mengsel is vastgesteld, is het vinden van de dichtheid van het gas een eenvoudige berekening. Verdeel de molecuulmassa door het standaardvolume (22,4 L / mol). Vergeet niet dat u STP en 1 mol gas aanneemt.[13]