De empirische formule van een verbinding is de eenvoudigste geschreven uitdrukking van zijn elementaire samenstelling. Je zou in staat moeten zijn om de empirische formule voor elke verbinding te bepalen, zolang je de massa van elk aanwezig element, het percentage van massa voor elk huidig element, of de moleculaire formule van de verbinding kent.
Methode één van de drie:
Methode één: gebruik van gewichtsprocenten [1]
-
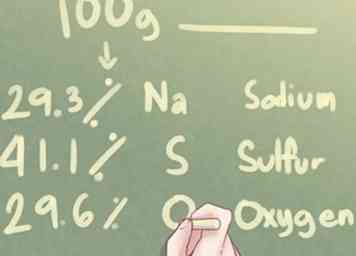 1 Kijk naar de gegevens. Als u de elementaire samenstelling van een onbekende stof in procenten in plaats van in grammen krijgt, moet u ervan uitgaan dat er precies 100,0 gram van de stof is.
1 Kijk naar de gegevens. Als u de elementaire samenstelling van een onbekende stof in procenten in plaats van in grammen krijgt, moet u ervan uitgaan dat er precies 100,0 gram van de stof is. - Dit zijn de instructies die u moet volgen als het bovenstaande waar is. Als u de elementaire samenstelling van een onbekende stof in grammen hebt gekregen, raadpleegt u het gedeelte "Gewicht in grammen gebruiken".
- Voorbeeld: Bepaal de empirische formule van een verbinding gemaakt van 29,3% Na (natrium), 41,1% S (zwavel) en 29,6% O (zuurstof).
-
 2 Bepaal het aantal grammen voor elk element. Op basis van de aanname dat er 100 gram van de onbekende stof is, kunt u bepalen dat het aantal grammen dat aanwezig is voor elk element gelijk is aan het percentage van elk element dat in het probleem wordt genoemd.
2 Bepaal het aantal grammen voor elk element. Op basis van de aanname dat er 100 gram van de onbekende stof is, kunt u bepalen dat het aantal grammen dat aanwezig is voor elk element gelijk is aan het percentage van elk element dat in het probleem wordt genoemd. - Voorbeeld: Voor 100 g onbekende stof zijn er 29,3 g Na, 41,1 g S en 29,6 g O.
-
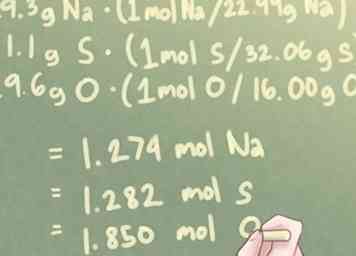 3 Converteer de massa van elk element in mollen. De massa van elk element in je compositie, momenteel uitgedrukt in grammen, moet worden omgezet in mollen. Om dit te doen, moet elke massa worden vermenigvuldigd met de molverhouding per hun respectieve atoomgewichten.
3 Converteer de massa van elk element in mollen. De massa van elk element in je compositie, momenteel uitgedrukt in grammen, moet worden omgezet in mollen. Om dit te doen, moet elke massa worden vermenigvuldigd met de molverhouding per hun respectieve atoomgewichten. - In eenvoudiger bewoordingen, moet je elke massa delen door het atoomgewicht van dat element.
- Merk ook op dat de atoomgewichten die in deze berekening worden gebruikt ten minste vier significante cijfers moeten bevatten.
- Voorbeeld: Voor een verbinding met 29,3 g Na, 41,1 g S en 29,6 g O:
- 29,3 g Na * (1 mol S / 22,99 g Na) = 1,274 mol Na
- 41,1 g S * (1 mol S / 32,06 g S) = 1,282 mol S
- 29,6 g O * (1 mol O / 16,00 g O) = 1,850 mol O
-
 4 Verdeel elke molwaarde door het kleinste aantal aanwezige moedervlekken. Je hebt een stochiometrische vergelijking tussen de elementen in uw samenstelling, wat in feite betekent dat u moet berekenen hoeveel van een element u heeft in relatie tot de andere elementen die aanwezig zijn in uw verbinding. Om dit te doen, verdeel elk aantal mollen door het kleinste aantal aanwezige moedervlekken.
4 Verdeel elke molwaarde door het kleinste aantal aanwezige moedervlekken. Je hebt een stochiometrische vergelijking tussen de elementen in uw samenstelling, wat in feite betekent dat u moet berekenen hoeveel van een element u heeft in relatie tot de andere elementen die aanwezig zijn in uw verbinding. Om dit te doen, verdeel elk aantal mollen door het kleinste aantal aanwezige moedervlekken. - Voorbeeld: Het kleinste aantal molen aanwezig in de verbinding is 1,274 mol (het aantal mol voor Na, natrium).
- 1,274 mol Na / 1,274 mol = 1.000 Na
- 1.282 mol S / 1.274 mol = 1.006 S
- 1,850 mol O / 1,274 mol = 1,452
- Voorbeeld: Het kleinste aantal molen aanwezig in de verbinding is 1,274 mol (het aantal mol voor Na, natrium).
-
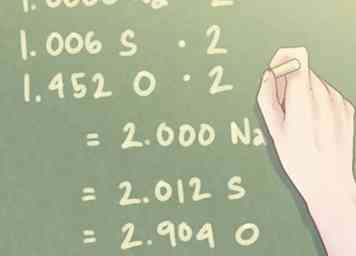 5 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. De hoeveelheid molen aanwezig voor elk element is mogelijk niet hetzelfde als hele getallen. Voor kleine waarden die binnen een tiende waarde verwijderd zijn van een geheel getal, levert dit geen probleem op. Als u echter een overschrijdingswaarde heeft die dit bedrag overschrijdt, moet u de verhoudingswaarden desgewenst vermenigvuldigen om die waarde op een geheel getal te brengen.
5 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. De hoeveelheid molen aanwezig voor elk element is mogelijk niet hetzelfde als hele getallen. Voor kleine waarden die binnen een tiende waarde verwijderd zijn van een geheel getal, levert dit geen probleem op. Als u echter een overschrijdingswaarde heeft die dit bedrag overschrijdt, moet u de verhoudingswaarden desgewenst vermenigvuldigen om die waarde op een geheel getal te brengen. - Als een element een waarde heeft in de buurt van 0,5, vermenigvuldig elk element dan met 2. Op dezelfde manier, als een element een waarde heeft in de buurt van 0,25, vermenigvuldig elk element met 4.
- Voorbeeld: Aangezien de hoeveelheid zuurstof (O) aanwezig is in de buurt van 1,5, moet u elke waarde vermenigvuldigen met "2" om de verhouding zuurstof dichter bij een geheel getal te brengen.
- 1.000 Na * 2 = 2.000 Na
- 1.006 S * 2 = 2.012 S
- 1.452 O * 2 = 2.904 O
-
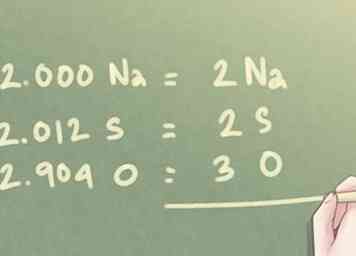 6 Rond de waarden af naar de dichtstbijzijnde hele getallen. Zelfs na de laatste stap is het aantal mol dat voor elk element aanwezig is mogelijk niet in hele getallen. Aangezien er geen decimalen worden gebruikt in empirische formules, moet u elke waarde naar het dichtstbijzijnde gehele getal afronden.
6 Rond de waarden af naar de dichtstbijzijnde hele getallen. Zelfs na de laatste stap is het aantal mol dat voor elk element aanwezig is mogelijk niet in hele getallen. Aangezien er geen decimalen worden gebruikt in empirische formules, moet u elke waarde naar het dichtstbijzijnde gehele getal afronden. - Voorbeeld: Voor de verhouding bepaald in de vorige stap:
- 2.000 Na kan worden geschreven als 2 Na.
- 2.012 S kan worden afgerond naar beneden naar 2 S.
- 2.904 O kan worden afgerond naar maximaal 3 O.
- Voorbeeld: Voor de verhouding bepaald in de vorige stap:
-
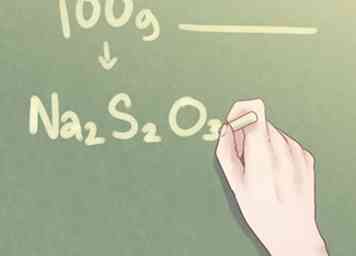 7 Schrijf je laatste antwoord. Vertaal de verhouding van elementen in het standaardformaat dat wordt gebruikt voor de empirische formule. De moleculaire hoeveelheid van elk element moet worden aangegeven in subscript naast het symbool van het respectieve element voor alle hoeveelheden groter dan één.
7 Schrijf je laatste antwoord. Vertaal de verhouding van elementen in het standaardformaat dat wordt gebruikt voor de empirische formule. De moleculaire hoeveelheid van elk element moet worden aangegeven in subscript naast het symbool van het respectieve element voor alle hoeveelheden groter dan één. - Voorbeeld: Voor een verbinding die bestaat uit 2 delen Na, 2 delen S en 3 delen O, moet de empirische formule worden geschreven als: Na2S2O3
Methode twee van drie:
Methode twee: Gewicht in grammen gebruiken
-
 1 Overweeg het aantal grammen. Als u de elementaire samenstelling van een onbekende stof in grammen krijgt, dient u verder te gaan volgens de onderstaande instructies.
1 Overweeg het aantal grammen. Als u de elementaire samenstelling van een onbekende stof in grammen krijgt, dient u verder te gaan volgens de onderstaande instructies. - Als u de compositie echter in percentages in plaats van in grammen krijgt, raadpleegt u de instructies bij 'Gewichtspercentages gebruiken'.
- Voorbeeld: Bepaal de empirische formule van een onbekende stof gemaakt van 8,5 g Fe (ijzer) en 3,8 g O (zuurstof.)
-
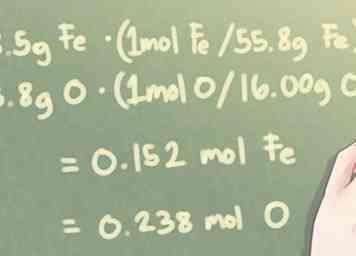 2 Converteer de massa van elk element in mollen. Om de moleculaire verhouding van elementen in de verbinding te bepalen, moet u de hoeveelheid van elk element omzetten van gram naar aantal mol. Doe dit door de massa in gram voor elk element te delen door de respectieve atoomgewichten van de elementen.
2 Converteer de massa van elk element in mollen. Om de moleculaire verhouding van elementen in de verbinding te bepalen, moet u de hoeveelheid van elk element omzetten van gram naar aantal mol. Doe dit door de massa in gram voor elk element te delen door de respectieve atoomgewichten van de elementen. - Vanuit een meer technisch perspectief, vermenigvuldig je in feite de massa in grammen met de molverhouding per atoomgewicht.
- Merk op dat het atoomgewicht naar vier significante plaatsen moet worden afgerond om een zekere mate van nauwkeurigheid in uw berekeningen te behouden.
- Voorbeeld: Wanneer er 8,5 g Fe en 3,8 g O zijn:
- 8,5 g Fe * (1 mol Fe / 55,85 g Fe) = 0,152 mol Fe
- 3,8 g O * (1 mol O / 16,00 g O) = 0,238 mol O
-
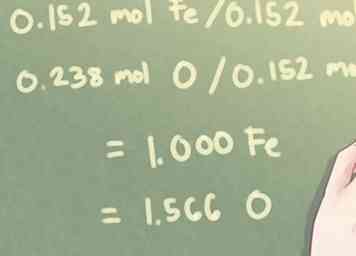 3 Verdeel elke molwaarde door het kleinste berekende getal. Bepaal hoeveel van elk element aanwezig is in vergelijking met de andere elementen in de verbinding.Om dit te berekenen, moet u het kleinste aantal aanwezige moedervlekken identificeren en elk aantal moedervliezen delen door dat aantal.
3 Verdeel elke molwaarde door het kleinste berekende getal. Bepaal hoeveel van elk element aanwezig is in vergelijking met de andere elementen in de verbinding.Om dit te berekenen, moet u het kleinste aantal aanwezige moedervlekken identificeren en elk aantal moedervliezen delen door dat aantal. - Voorbeeld: Voor dit probleem is de kleinste hoeveelheid aanwezige molen 0,152 mol (de hoeveelheid Fe, ijzer, aanwezig).
- 0,152 mol Fe / 0,152 mol = 1.000 Fe
- 0.238 mol O / 0.152 mol = 1.566 O
- Voorbeeld: Voor dit probleem is de kleinste hoeveelheid aanwezige molen 0,152 mol (de hoeveelheid Fe, ijzer, aanwezig).
-
 4 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. Vaak zijn de aanwezige mol voor elke stof mogelijk niet gelijk aan een geheel getal. Als het overschot binnen een tiende ligt, kun je het eenvoudigweg afronden. Voor overtollige waarden die dit overschrijden, moet u echter elke waarde vermenigvuldigen met een getal dat de verhoudingswaarde dichter bij een geheel getal kan brengen.
4 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. Vaak zijn de aanwezige mol voor elke stof mogelijk niet gelijk aan een geheel getal. Als het overschot binnen een tiende ligt, kun je het eenvoudigweg afronden. Voor overtollige waarden die dit overschrijden, moet u echter elke waarde vermenigvuldigen met een getal dat de verhoudingswaarde dichter bij een geheel getal kan brengen. - Als een element bijvoorbeeld een overmaat heeft van bijna 0,25, vermenigvuldigt u elke elementhoeveelheid met 4. Als een element een overmaat heeft in de buurt van 0,5, vermenigvuldigt u elke elementhoeveelheid met 2.
- Voorbeeld: Omdat de ratio zuurstof gelijk is aan 1.566, moet je beide verhoudingsbedragen vermenigvuldigen met 2.
- 1.000 Fe * 2 = 2.000 Fe
- 1.566 O * 2 = 3.132 O
-
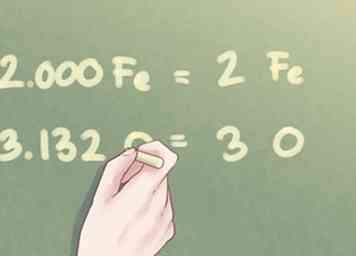 5 Rond je antwoord af op het dichtstbijzijnde hele getal. Zodra de verhoudingswaarden van alle elementen in de compound grofweg binnen een tiende van een geheel getal liggen, kunt u elk verschil naar het dichtstbijzijnde gehele getal afronden.
5 Rond je antwoord af op het dichtstbijzijnde hele getal. Zodra de verhoudingswaarden van alle elementen in de compound grofweg binnen een tiende van een geheel getal liggen, kunt u elk verschil naar het dichtstbijzijnde gehele getal afronden. - Voorbeeld: De hoeveelheid Fe kan worden geschreven als 2. De hoeveelheid O kan worden afgerond naar beneden naar 3.
-
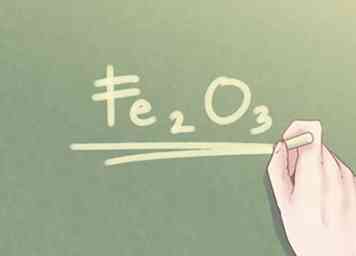 6 Schrijf het laatste antwoord. De verhouding van elementen moet worden herschreven in de vorm van een empirische formule. Elke verhoudingswaarde moet worden aangegeven in subscript naast het symbool van het respectieve element, tenzij de verhoudingswaarde gelijk is aan één.
6 Schrijf het laatste antwoord. De verhouding van elementen moet worden herschreven in de vorm van een empirische formule. Elke verhoudingswaarde moet worden aangegeven in subscript naast het symbool van het respectieve element, tenzij de verhoudingswaarde gelijk is aan één. - Voorbeeld: Voor een verbinding die bestaat uit 2 delen Fe en 3 delen O, is de empirische formule: Fe2O3
Methode drie van drie:
Methode drie: Moleculaire formule gebruiken [2]
-
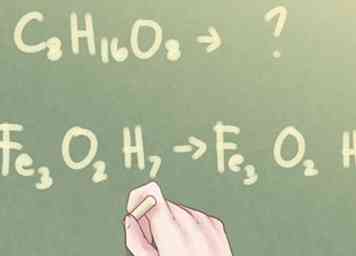 1 Bepaal of de subscripts kunnen worden verminderd. Als u de molecuulformule van een onbekende verbinding heeft maar wordt verteld om de verbinding te identificeren aan de hand van de empirische formule, moet u bepalen of de formule kan worden verminderd. Kijk naar de subscripts voor elk aanwezig element. Als alle drie subscripts ten minste één gemeenschappelijke factor delen (anders dan nummer 1), moet u nog een paar stappen nemen om de empirische formule van de samengestelde formule te bepalen.
1 Bepaal of de subscripts kunnen worden verminderd. Als u de molecuulformule van een onbekende verbinding heeft maar wordt verteld om de verbinding te identificeren aan de hand van de empirische formule, moet u bepalen of de formule kan worden verminderd. Kijk naar de subscripts voor elk aanwezig element. Als alle drie subscripts ten minste één gemeenschappelijke factor delen (anders dan nummer 1), moet u nog een paar stappen nemen om de empirische formule van de samengestelde formule te bepalen. - Voorbeeld: C8H16O8
- Aan de andere kant, als de subscripten niet allemaal dezelfde factor hebben, is de molecuulformule ook de empirische formule.
- Voorbeeld: Fe3O2H7
-
 2 Zoek de grootste gemene deler tussen de subscripts. Schrijf de factoren van elk subscript in uw formule. Bepaal welke factor de grootste waarde heeft.
2 Zoek de grootste gemene deler tussen de subscripts. Schrijf de factoren van elk subscript in uw formule. Bepaal welke factor de grootste waarde heeft. - Voorbeeld: Voor C8H16O8, de subscripts zijn "16" en "8."
- De factoren van 8 zijn: 1, 2, 4, 8
- De factoren van 16 zijn: 1, 2, 4, 8, 16
- De grootste gemene deler (GCF) tussen de twee cijfers is 8.
- Voorbeeld: Voor C8H16O8, de subscripts zijn "16" en "8."
-
 3 Verdeel elk subscript met de grootste gemene deler. Als u elk subscript in de eenvoudigste vorm wilt ophalen, moet u alle subscripts die in de formule aanwezig zijn, door de GCF verdelen die u zojuist hebt gevonden.
3 Verdeel elk subscript met de grootste gemene deler. Als u elk subscript in de eenvoudigste vorm wilt ophalen, moet u alle subscripts die in de formule aanwezig zijn, door de GCF verdelen die u zojuist hebt gevonden. - Voorbeeld: Voor C8H16O8:
- Verdeel het subscript van 8 door de GCF van 8: 8/8 = 1
- Deel het subscript van 16 door de GCF van 8: 16/8 = 2
- Voorbeeld: Voor C8H16O8:
-
 4 Schrijf het laatste antwoord. Vervang uw originele subscripts door hun vereenvoudigde waarden. Daarbij hebt u de empirische formule van de verbinding bepaald op basis van de moleculaire formule.
4 Schrijf het laatste antwoord. Vervang uw originele subscripts door hun vereenvoudigde waarden. Daarbij hebt u de empirische formule van de verbinding bepaald op basis van de moleculaire formule. - Merk op dat waarden van 1 meestal niet worden aangegeven met subscripts.
- Voorbeeld: C8H16O8 = CH2O
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
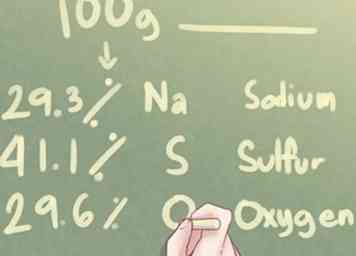 1 Kijk naar de gegevens. Als u de elementaire samenstelling van een onbekende stof in procenten in plaats van in grammen krijgt, moet u ervan uitgaan dat er precies 100,0 gram van de stof is.
1 Kijk naar de gegevens. Als u de elementaire samenstelling van een onbekende stof in procenten in plaats van in grammen krijgt, moet u ervan uitgaan dat er precies 100,0 gram van de stof is.  2 Bepaal het aantal grammen voor elk element. Op basis van de aanname dat er 100 gram van de onbekende stof is, kunt u bepalen dat het aantal grammen dat aanwezig is voor elk element gelijk is aan het percentage van elk element dat in het probleem wordt genoemd.
2 Bepaal het aantal grammen voor elk element. Op basis van de aanname dat er 100 gram van de onbekende stof is, kunt u bepalen dat het aantal grammen dat aanwezig is voor elk element gelijk is aan het percentage van elk element dat in het probleem wordt genoemd. 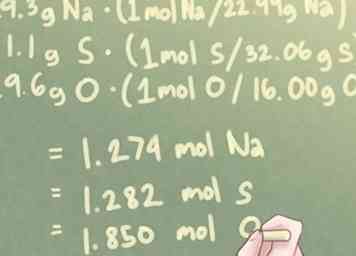 3 Converteer de massa van elk element in mollen. De massa van elk element in je compositie, momenteel uitgedrukt in grammen, moet worden omgezet in mollen. Om dit te doen, moet elke massa worden vermenigvuldigd met de molverhouding per hun respectieve atoomgewichten.
3 Converteer de massa van elk element in mollen. De massa van elk element in je compositie, momenteel uitgedrukt in grammen, moet worden omgezet in mollen. Om dit te doen, moet elke massa worden vermenigvuldigd met de molverhouding per hun respectieve atoomgewichten.  4 Verdeel elke molwaarde door het kleinste aantal aanwezige moedervlekken. Je hebt een stochiometrische vergelijking tussen de elementen in uw samenstelling, wat in feite betekent dat u moet berekenen hoeveel van een element u heeft in relatie tot de andere elementen die aanwezig zijn in uw verbinding. Om dit te doen, verdeel elk aantal mollen door het kleinste aantal aanwezige moedervlekken.
4 Verdeel elke molwaarde door het kleinste aantal aanwezige moedervlekken. Je hebt een stochiometrische vergelijking tussen de elementen in uw samenstelling, wat in feite betekent dat u moet berekenen hoeveel van een element u heeft in relatie tot de andere elementen die aanwezig zijn in uw verbinding. Om dit te doen, verdeel elk aantal mollen door het kleinste aantal aanwezige moedervlekken. 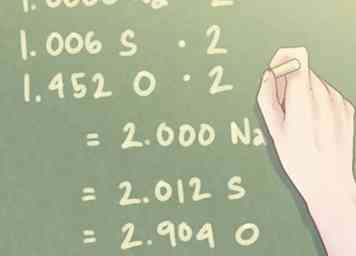 5 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. De hoeveelheid molen aanwezig voor elk element is mogelijk niet hetzelfde als hele getallen. Voor kleine waarden die binnen een tiende waarde verwijderd zijn van een geheel getal, levert dit geen probleem op. Als u echter een overschrijdingswaarde heeft die dit bedrag overschrijdt, moet u de verhoudingswaarden desgewenst vermenigvuldigen om die waarde op een geheel getal te brengen.
5 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. De hoeveelheid molen aanwezig voor elk element is mogelijk niet hetzelfde als hele getallen. Voor kleine waarden die binnen een tiende waarde verwijderd zijn van een geheel getal, levert dit geen probleem op. Als u echter een overschrijdingswaarde heeft die dit bedrag overschrijdt, moet u de verhoudingswaarden desgewenst vermenigvuldigen om die waarde op een geheel getal te brengen. 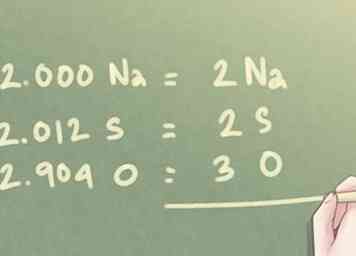 6 Rond de waarden af naar de dichtstbijzijnde hele getallen. Zelfs na de laatste stap is het aantal mol dat voor elk element aanwezig is mogelijk niet in hele getallen. Aangezien er geen decimalen worden gebruikt in empirische formules, moet u elke waarde naar het dichtstbijzijnde gehele getal afronden.
6 Rond de waarden af naar de dichtstbijzijnde hele getallen. Zelfs na de laatste stap is het aantal mol dat voor elk element aanwezig is mogelijk niet in hele getallen. Aangezien er geen decimalen worden gebruikt in empirische formules, moet u elke waarde naar het dichtstbijzijnde gehele getal afronden. 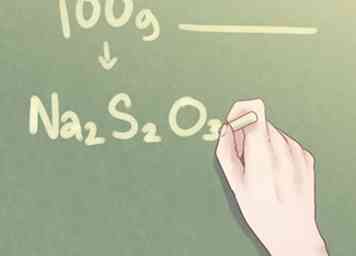 7 Schrijf je laatste antwoord. Vertaal de verhouding van elementen in het standaardformaat dat wordt gebruikt voor de empirische formule. De moleculaire hoeveelheid van elk element moet worden aangegeven in subscript naast het symbool van het respectieve element voor alle hoeveelheden groter dan één.
7 Schrijf je laatste antwoord. Vertaal de verhouding van elementen in het standaardformaat dat wordt gebruikt voor de empirische formule. De moleculaire hoeveelheid van elk element moet worden aangegeven in subscript naast het symbool van het respectieve element voor alle hoeveelheden groter dan één.  1 Overweeg het aantal grammen. Als u de elementaire samenstelling van een onbekende stof in grammen krijgt, dient u verder te gaan volgens de onderstaande instructies.
1 Overweeg het aantal grammen. Als u de elementaire samenstelling van een onbekende stof in grammen krijgt, dient u verder te gaan volgens de onderstaande instructies. 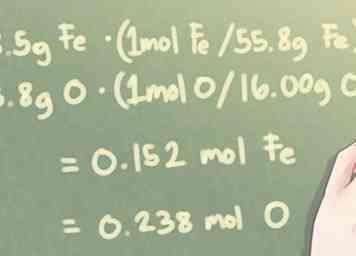 2 Converteer de massa van elk element in mollen. Om de moleculaire verhouding van elementen in de verbinding te bepalen, moet u de hoeveelheid van elk element omzetten van gram naar aantal mol. Doe dit door de massa in gram voor elk element te delen door de respectieve atoomgewichten van de elementen.
2 Converteer de massa van elk element in mollen. Om de moleculaire verhouding van elementen in de verbinding te bepalen, moet u de hoeveelheid van elk element omzetten van gram naar aantal mol. Doe dit door de massa in gram voor elk element te delen door de respectieve atoomgewichten van de elementen. 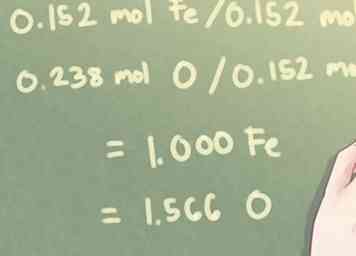 3 Verdeel elke molwaarde door het kleinste berekende getal. Bepaal hoeveel van elk element aanwezig is in vergelijking met de andere elementen in de verbinding.Om dit te berekenen, moet u het kleinste aantal aanwezige moedervlekken identificeren en elk aantal moedervliezen delen door dat aantal.
3 Verdeel elke molwaarde door het kleinste berekende getal. Bepaal hoeveel van elk element aanwezig is in vergelijking met de andere elementen in de verbinding.Om dit te berekenen, moet u het kleinste aantal aanwezige moedervlekken identificeren en elk aantal moedervliezen delen door dat aantal.  4 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. Vaak zijn de aanwezige mol voor elke stof mogelijk niet gelijk aan een geheel getal. Als het overschot binnen een tiende ligt, kun je het eenvoudigweg afronden. Voor overtollige waarden die dit overschrijden, moet u echter elke waarde vermenigvuldigen met een getal dat de verhoudingswaarde dichter bij een geheel getal kan brengen.
4 Vermenigvuldig de verhoudingswaarden om bijna hele getallen te vinden. Vaak zijn de aanwezige mol voor elke stof mogelijk niet gelijk aan een geheel getal. Als het overschot binnen een tiende ligt, kun je het eenvoudigweg afronden. Voor overtollige waarden die dit overschrijden, moet u echter elke waarde vermenigvuldigen met een getal dat de verhoudingswaarde dichter bij een geheel getal kan brengen. 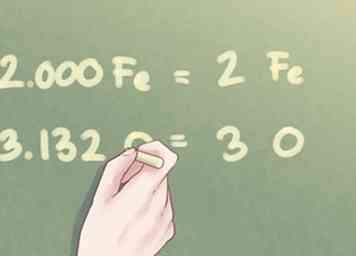 5 Rond je antwoord af op het dichtstbijzijnde hele getal. Zodra de verhoudingswaarden van alle elementen in de compound grofweg binnen een tiende van een geheel getal liggen, kunt u elk verschil naar het dichtstbijzijnde gehele getal afronden.
5 Rond je antwoord af op het dichtstbijzijnde hele getal. Zodra de verhoudingswaarden van alle elementen in de compound grofweg binnen een tiende van een geheel getal liggen, kunt u elk verschil naar het dichtstbijzijnde gehele getal afronden. 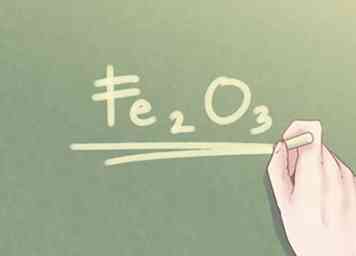 6 Schrijf het laatste antwoord. De verhouding van elementen moet worden herschreven in de vorm van een empirische formule. Elke verhoudingswaarde moet worden aangegeven in subscript naast het symbool van het respectieve element, tenzij de verhoudingswaarde gelijk is aan één.
6 Schrijf het laatste antwoord. De verhouding van elementen moet worden herschreven in de vorm van een empirische formule. Elke verhoudingswaarde moet worden aangegeven in subscript naast het symbool van het respectieve element, tenzij de verhoudingswaarde gelijk is aan één. 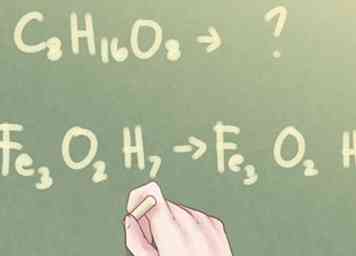 1 Bepaal of de subscripts kunnen worden verminderd. Als u de molecuulformule van een onbekende verbinding heeft maar wordt verteld om de verbinding te identificeren aan de hand van de empirische formule, moet u bepalen of de formule kan worden verminderd. Kijk naar de subscripts voor elk aanwezig element. Als alle drie subscripts ten minste één gemeenschappelijke factor delen (anders dan nummer 1), moet u nog een paar stappen nemen om de empirische formule van de samengestelde formule te bepalen.
1 Bepaal of de subscripts kunnen worden verminderd. Als u de molecuulformule van een onbekende verbinding heeft maar wordt verteld om de verbinding te identificeren aan de hand van de empirische formule, moet u bepalen of de formule kan worden verminderd. Kijk naar de subscripts voor elk aanwezig element. Als alle drie subscripts ten minste één gemeenschappelijke factor delen (anders dan nummer 1), moet u nog een paar stappen nemen om de empirische formule van de samengestelde formule te bepalen.  2 Zoek de grootste gemene deler tussen de subscripts. Schrijf de factoren van elk subscript in uw formule. Bepaal welke factor de grootste waarde heeft.
2 Zoek de grootste gemene deler tussen de subscripts. Schrijf de factoren van elk subscript in uw formule. Bepaal welke factor de grootste waarde heeft.  3 Verdeel elk subscript met de grootste gemene deler. Als u elk subscript in de eenvoudigste vorm wilt ophalen, moet u alle subscripts die in de formule aanwezig zijn, door de GCF verdelen die u zojuist hebt gevonden.
3 Verdeel elk subscript met de grootste gemene deler. Als u elk subscript in de eenvoudigste vorm wilt ophalen, moet u alle subscripts die in de formule aanwezig zijn, door de GCF verdelen die u zojuist hebt gevonden.  4 Schrijf het laatste antwoord. Vervang uw originele subscripts door hun vereenvoudigde waarden. Daarbij hebt u de empirische formule van de verbinding bepaald op basis van de moleculaire formule.
4 Schrijf het laatste antwoord. Vervang uw originele subscripts door hun vereenvoudigde waarden. Daarbij hebt u de empirische formule van de verbinding bepaald op basis van de moleculaire formule.