Een verdunning in de chemie is een proces dat de concentratie van een stof in een oplossing vermindert. Een seriële verdunning is de herhaalde verdunning van een oplossing om de verdunningsfactor snel te versterken.[1] Het wordt vaak uitgevoerd in experimenten die sterk verdunde oplossingen vereisen, zoals die met concentratiegrafieken op een logaritmische schaal of wanneer u de dichtheid van bacteriën bepaalt. Seriële verdunningen worden op grote schaal gebruikt in experimentele wetenschappen zoals biochemie, microbiologie, farmacologie en fysica.
Methode één van de twee:
Een basisverdunning uitvoeren
-
 1 Bepaal de juiste verdunningsvloeistof. De vloeistof die je gaat verdunnen, is erg belangrijk. Veel oplossingen worden verdund in gedistilleerd water, maar dit is niet altijd het geval. Als u bacteriën of andere cellen verdunt, wilt u waarschijnlijk verdunnen in kweekmedia.[2] De vloeistof die u kiest, zal voor elke seriële verdunning worden gebruikt.
1 Bepaal de juiste verdunningsvloeistof. De vloeistof die je gaat verdunnen, is erg belangrijk. Veel oplossingen worden verdund in gedistilleerd water, maar dit is niet altijd het geval. Als u bacteriën of andere cellen verdunt, wilt u waarschijnlijk verdunnen in kweekmedia.[2] De vloeistof die u kiest, zal voor elke seriële verdunning worden gebruikt. - Als u niet zeker weet welke vloeistof u moet gebruiken, vraag dan om hulp of controleer online om te zien of andere personen een vergelijkbare verdunning hebben uitgevoerd.
-
 2 Bereid meerdere reageerbuizen met 9 ml verdunningsvloeistof. Deze buizen zullen dienen als verdunningsspaties.[3] U voegt uw onverdund monster toe aan de eerste buis en verdunt het vervolgens in de volgende buisjes.
2 Bereid meerdere reageerbuizen met 9 ml verdunningsvloeistof. Deze buizen zullen dienen als verdunningsspaties.[3] U voegt uw onverdund monster toe aan de eerste buis en verdunt het vervolgens in de volgende buisjes. - Het is handig om al je tubes te labelen voordat je begint, zodat je niet in de war raakt als je begint met de verdunningen.
- Elke buis zal een 10-voudige verdunning zijn uitgaande van de onverdunde buis.[4] De eerste buis is een 1:10 verdunning, de tweede een 1: 100, de derde een 1: 1000, etc. Bepaal het aantal verdunningen dat u van tevoren moet doen, zodat u geen buizen of verdunningsvloeistof verspilt.
-
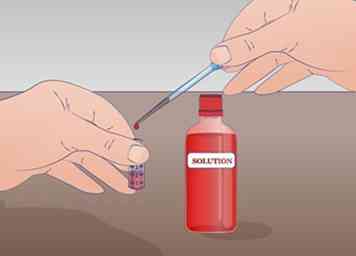 3 Bereid een reageerbuisje met ten minste 2 ml van uw onverdunde oplossing. De minimale hoeveelheid die nodig is om deze seriële verdunning uit te voeren, is 1 ml onverdunde oplossing. Als u slechts 1 ml heeft, heeft u geen enkele resterende onverdunde oplossing. Label deze tube ONS voor onverdunde oplossing.
3 Bereid een reageerbuisje met ten minste 2 ml van uw onverdunde oplossing. De minimale hoeveelheid die nodig is om deze seriële verdunning uit te voeren, is 1 ml onverdunde oplossing. Als u slechts 1 ml heeft, heeft u geen enkele resterende onverdunde oplossing. Label deze tube ONS voor onverdunde oplossing. - Meng uw oplossing grondig voordat u verdunningen begint.[5]
-
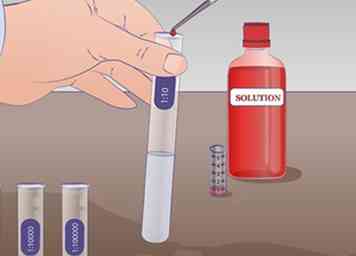 4 Voer de eerste verdunning uit. Zuig 1 ml onverdunde oplossing uit de reageerbuis ONS met een pipet en breng deze over naar de reageerbuis met het label 1:10 bevat 9 ml van de verdunningsvloeistof en meng grondig. Er is nu 1 ml van de onverdunde oplossing in 9 ml van de verdunningsvloeistof. De oplossing is daarom verdund met een factor 10.
4 Voer de eerste verdunning uit. Zuig 1 ml onverdunde oplossing uit de reageerbuis ONS met een pipet en breng deze over naar de reageerbuis met het label 1:10 bevat 9 ml van de verdunningsvloeistof en meng grondig. Er is nu 1 ml van de onverdunde oplossing in 9 ml van de verdunningsvloeistof. De oplossing is daarom verdund met een factor 10. -
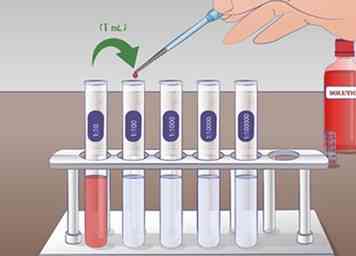 5 Voer de tweede verdunning uit. Voor de tweede seriële verdunning, neemt u 1 ml oplossing uit de tube 1:10 en voeg het toe aan de 9 mL verdunningsvloeistof in de buis 1:100. Meng de buis grondig 1:10 voor het toevoegen aan de volgende tube. Nogmaals, meng de tube 1:100 na verdunning. De oplossing uit de reageerbuis 1:10 is tienvoudig verdund in reageerbuis 1:100.
5 Voer de tweede verdunning uit. Voor de tweede seriële verdunning, neemt u 1 ml oplossing uit de tube 1:10 en voeg het toe aan de 9 mL verdunningsvloeistof in de buis 1:100. Meng de buis grondig 1:10 voor het toevoegen aan de volgende tube. Nogmaals, meng de tube 1:100 na verdunning. De oplossing uit de reageerbuis 1:10 is tienvoudig verdund in reageerbuis 1:100. -
 6 Verleng deze procedure om langere seriële verdunningen uit te voeren. Dit proces kan zo vaak als nodig worden herhaald om de gewenste oplossing te bereiken. In een experiment met concentratiegolven kunt u een seriële verdunning gebruiken om een reeks oplossingen te maken met verdunningen van 1, 1:10, 1: 100, 1: 1.000.
6 Verleng deze procedure om langere seriële verdunningen uit te voeren. Dit proces kan zo vaak als nodig worden herhaald om de gewenste oplossing te bereiken. In een experiment met concentratiegolven kunt u een seriële verdunning gebruiken om een reeks oplossingen te maken met verdunningen van 1, 1:10, 1: 100, 1: 1.000.
Methode twee van twee:
Berekening van de uiteindelijke verdunningsfactor en concentratie
-
 1 Bereken de uiteindelijke verdunningsverhouding in een seriële verdunning. De totale verdunningsverhouding kan worden bepaald door de verdunningsfactor van elke stap voorafgaand aan de laatste stap te vermenigvuldigen. Dit kan wiskundig worden geïllustreerd met de vergelijking Dt = D1 x D2 x D3 x ... x Dn waar Dt is de totale verdunningsfactor en Dn is de verdunningsverhouding.[6]
1 Bereken de uiteindelijke verdunningsverhouding in een seriële verdunning. De totale verdunningsverhouding kan worden bepaald door de verdunningsfactor van elke stap voorafgaand aan de laatste stap te vermenigvuldigen. Dit kan wiskundig worden geïllustreerd met de vergelijking Dt = D1 x D2 x D3 x ... x Dn waar Dt is de totale verdunningsfactor en Dn is de verdunningsverhouding.[6] - Laten we bijvoorbeeld zeggen dat je 4 keer een verdunning van 1:10 hebt gedaan. Steek je verdunningsfactor in de vergelijking: Dt = 10 x 10 x 10 x 10 = 10.000
- De uiteindelijke verdunningsfactor van de vierde buis in uw seriële verdunning is 1: 10.000. De concentratie van uw stof is nu 10.000 keer minder dan de oorspronkelijke onverdunde oplossing.
-
 2 Bepaal de concentratie van de oplossing na verdunning. Om de uiteindelijke concentratie van uw oplossing te bepalen na een seriële verdunning, moet u uw startconcentratie kennen. De vergelijking is Claatste = Ceerste/ D waar Claatste is de eindconcentratie van de verdunde oplossing, Ceerste is de beginconcentratie van de oorspronkelijke oplossing en D is de eerder vastgestelde verdunningsverhouding.[7]
2 Bepaal de concentratie van de oplossing na verdunning. Om de uiteindelijke concentratie van uw oplossing te bepalen na een seriële verdunning, moet u uw startconcentratie kennen. De vergelijking is Claatste = Ceerste/ D waar Claatste is de eindconcentratie van de verdunde oplossing, Ceerste is de beginconcentratie van de oorspronkelijke oplossing en D is de eerder vastgestelde verdunningsverhouding.[7] - Bijvoorbeeld: als u bent begonnen met een oplossing van cellen met een concentratie van 1.000.000 cellen per ml en uw verdunningsverhouding is 1.000, wat is de uiteindelijke concentratie van uw verdunde monster?
- De vergelijking gebruiken:
- Claatste = Ceerste/ D
- Claatste = 1,000,000/1,000
- Claatste = 1.000 cellen per ml.
-
 3 Controleer of alle eenheden overeenkomen. Wanneer u een berekening uitvoert, wilt u ervoor zorgen dat uw eenheden altijd overeenkomen aan het einde.[8] Als u met cellen per ml bent begonnen, zorg er dan voor dat u eindigt met cellen per ml. Als uw startconcentratie delen per miljoen (ppm) is, moet uw uiteindelijke concentratie dpm zijn.
3 Controleer of alle eenheden overeenkomen. Wanneer u een berekening uitvoert, wilt u ervoor zorgen dat uw eenheden altijd overeenkomen aan het einde.[8] Als u met cellen per ml bent begonnen, zorg er dan voor dat u eindigt met cellen per ml. Als uw startconcentratie delen per miljoen (ppm) is, moet uw uiteindelijke concentratie dpm zijn.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Bepaal de juiste verdunningsvloeistof. De vloeistof die je gaat verdunnen, is erg belangrijk. Veel oplossingen worden verdund in gedistilleerd water, maar dit is niet altijd het geval. Als u bacteriën of andere cellen verdunt, wilt u waarschijnlijk verdunnen in kweekmedia.[2] De vloeistof die u kiest, zal voor elke seriële verdunning worden gebruikt.
1 Bepaal de juiste verdunningsvloeistof. De vloeistof die je gaat verdunnen, is erg belangrijk. Veel oplossingen worden verdund in gedistilleerd water, maar dit is niet altijd het geval. Als u bacteriën of andere cellen verdunt, wilt u waarschijnlijk verdunnen in kweekmedia.[2] De vloeistof die u kiest, zal voor elke seriële verdunning worden gebruikt.  2 Bereid meerdere reageerbuizen met 9 ml verdunningsvloeistof. Deze buizen zullen dienen als verdunningsspaties.[3] U voegt uw onverdund monster toe aan de eerste buis en verdunt het vervolgens in de volgende buisjes.
2 Bereid meerdere reageerbuizen met 9 ml verdunningsvloeistof. Deze buizen zullen dienen als verdunningsspaties.[3] U voegt uw onverdund monster toe aan de eerste buis en verdunt het vervolgens in de volgende buisjes.  3 Bereid een reageerbuisje met ten minste 2 ml van uw onverdunde oplossing. De minimale hoeveelheid die nodig is om deze seriële verdunning uit te voeren, is 1 ml onverdunde oplossing. Als u slechts 1 ml heeft, heeft u geen enkele resterende onverdunde oplossing. Label deze tube ONS voor onverdunde oplossing.
3 Bereid een reageerbuisje met ten minste 2 ml van uw onverdunde oplossing. De minimale hoeveelheid die nodig is om deze seriële verdunning uit te voeren, is 1 ml onverdunde oplossing. Als u slechts 1 ml heeft, heeft u geen enkele resterende onverdunde oplossing. Label deze tube ONS voor onverdunde oplossing.  4 Voer de eerste verdunning uit. Zuig 1 ml onverdunde oplossing uit de reageerbuis ONS met een pipet en breng deze over naar de reageerbuis met het label 1:10 bevat 9 ml van de verdunningsvloeistof en meng grondig. Er is nu 1 ml van de onverdunde oplossing in 9 ml van de verdunningsvloeistof. De oplossing is daarom verdund met een factor 10.
4 Voer de eerste verdunning uit. Zuig 1 ml onverdunde oplossing uit de reageerbuis ONS met een pipet en breng deze over naar de reageerbuis met het label 1:10 bevat 9 ml van de verdunningsvloeistof en meng grondig. Er is nu 1 ml van de onverdunde oplossing in 9 ml van de verdunningsvloeistof. De oplossing is daarom verdund met een factor 10.  5 Voer de tweede verdunning uit. Voor de tweede seriële verdunning, neemt u 1 ml oplossing uit de tube 1:10 en voeg het toe aan de 9 mL verdunningsvloeistof in de buis 1:100. Meng de buis grondig 1:10 voor het toevoegen aan de volgende tube. Nogmaals, meng de tube 1:100 na verdunning. De oplossing uit de reageerbuis 1:10 is tienvoudig verdund in reageerbuis 1:100.
5 Voer de tweede verdunning uit. Voor de tweede seriële verdunning, neemt u 1 ml oplossing uit de tube 1:10 en voeg het toe aan de 9 mL verdunningsvloeistof in de buis 1:100. Meng de buis grondig 1:10 voor het toevoegen aan de volgende tube. Nogmaals, meng de tube 1:100 na verdunning. De oplossing uit de reageerbuis 1:10 is tienvoudig verdund in reageerbuis 1:100.  6 Verleng deze procedure om langere seriële verdunningen uit te voeren. Dit proces kan zo vaak als nodig worden herhaald om de gewenste oplossing te bereiken. In een experiment met concentratiegolven kunt u een seriële verdunning gebruiken om een reeks oplossingen te maken met verdunningen van 1, 1:10, 1: 100, 1: 1.000.
6 Verleng deze procedure om langere seriële verdunningen uit te voeren. Dit proces kan zo vaak als nodig worden herhaald om de gewenste oplossing te bereiken. In een experiment met concentratiegolven kunt u een seriële verdunning gebruiken om een reeks oplossingen te maken met verdunningen van 1, 1:10, 1: 100, 1: 1.000.  1 Bereken de uiteindelijke verdunningsverhouding in een seriële verdunning. De totale verdunningsverhouding kan worden bepaald door de verdunningsfactor van elke stap voorafgaand aan de laatste stap te vermenigvuldigen. Dit kan wiskundig worden geïllustreerd met de vergelijking Dt = D1 x D2 x D3 x ... x Dn waar Dt is de totale verdunningsfactor en Dn is de verdunningsverhouding.[6]
1 Bereken de uiteindelijke verdunningsverhouding in een seriële verdunning. De totale verdunningsverhouding kan worden bepaald door de verdunningsfactor van elke stap voorafgaand aan de laatste stap te vermenigvuldigen. Dit kan wiskundig worden geïllustreerd met de vergelijking Dt = D1 x D2 x D3 x ... x Dn waar Dt is de totale verdunningsfactor en Dn is de verdunningsverhouding.[6]  2 Bepaal de concentratie van de oplossing na verdunning. Om de uiteindelijke concentratie van uw oplossing te bepalen na een seriële verdunning, moet u uw startconcentratie kennen. De vergelijking is Claatste = Ceerste/ D waar Claatste is de eindconcentratie van de verdunde oplossing, Ceerste is de beginconcentratie van de oorspronkelijke oplossing en D is de eerder vastgestelde verdunningsverhouding.[7]
2 Bepaal de concentratie van de oplossing na verdunning. Om de uiteindelijke concentratie van uw oplossing te bepalen na een seriële verdunning, moet u uw startconcentratie kennen. De vergelijking is Claatste = Ceerste/ D waar Claatste is de eindconcentratie van de verdunde oplossing, Ceerste is de beginconcentratie van de oorspronkelijke oplossing en D is de eerder vastgestelde verdunningsverhouding.[7]  3 Controleer of alle eenheden overeenkomen. Wanneer u een berekening uitvoert, wilt u ervoor zorgen dat uw eenheden altijd overeenkomen aan het einde.[8] Als u met cellen per ml bent begonnen, zorg er dan voor dat u eindigt met cellen per ml. Als uw startconcentratie delen per miljoen (ppm) is, moet uw uiteindelijke concentratie dpm zijn.
3 Controleer of alle eenheden overeenkomen. Wanneer u een berekening uitvoert, wilt u ervoor zorgen dat uw eenheden altijd overeenkomen aan het einde.[8] Als u met cellen per ml bent begonnen, zorg er dan voor dat u eindigt met cellen per ml. Als uw startconcentratie delen per miljoen (ppm) is, moet uw uiteindelijke concentratie dpm zijn.