Oplosbaarheid wordt in de chemie gebruikt om de eigenschappen van een vaste stof te beschrijven die wordt gemengd met en volledig oplost in een vloeistof zonder enige onopgeloste deeltjes achter te laten. Alleen ionische (geladen) verbindingen zijn oplosbaar. Voor praktische doeleinden is het onthouden van een paar regels of het verwijzen naar een lijst ervan genoeg om u te vertellen of de meeste ionische verbindingen solide blijven wanneer ze in water vallen, of dat een aanzienlijke hoeveelheid zal oplossen. In werkelijkheid zal een aantal moleculen oplossen, zelfs als je de verandering niet kunt zien, dus voor precieze experimenten moet je misschien weten hoe je dit bedrag kunt berekenen.
Methode één van de twee:
Snelle regels gebruiken
-
 1 Meer informatie over ionische verbindingen. Elk atoom heeft normaal een bepaald aantal elektronen, maar soms nemen ze een extra elektron op of verliezen ze door een proces dat bekend staat als elektronenoverdracht.[1] Het resultaat is een ion, die een elektrische lading heeft. Wanneer een ion met een negatieve lading (een extra elektron) een ion ontmoet met een positieve lading (een elektron ontbreekt), binden ze zich samen net als de negatieve en positieve uiteinden van 2 magneten. Het resultaat is een ionische verbinding.
1 Meer informatie over ionische verbindingen. Elk atoom heeft normaal een bepaald aantal elektronen, maar soms nemen ze een extra elektron op of verliezen ze door een proces dat bekend staat als elektronenoverdracht.[1] Het resultaat is een ion, die een elektrische lading heeft. Wanneer een ion met een negatieve lading (een extra elektron) een ion ontmoet met een positieve lading (een elektron ontbreekt), binden ze zich samen net als de negatieve en positieve uiteinden van 2 magneten. Het resultaat is een ionische verbinding. - Ionen met negatieve ladingen worden genoemd anionen, terwijl ionen met positieve ladingen zijn kationen.
- Normaal gesproken is het aantal elektronen in een atoom gelijk aan het aantal protonen, waardoor de elektrische ladingen worden geëlimineerd.
-
 2 Begrijp de oplosbaarheid. Watermoleculen (H2O) hebben een ongewone structuur, waardoor ze lijken op een magneet: het ene uiteinde heeft een positieve lading, terwijl het andere einde negatief is. Wanneer je een ionische verbinding in water laat vallen, zullen deze watermagneten zich eromheen verzamelen en proberen de positieve en negatieve ionen uit elkaar te trekken.[2]
2 Begrijp de oplosbaarheid. Watermoleculen (H2O) hebben een ongewone structuur, waardoor ze lijken op een magneet: het ene uiteinde heeft een positieve lading, terwijl het andere einde negatief is. Wanneer je een ionische verbinding in water laat vallen, zullen deze watermagneten zich eromheen verzamelen en proberen de positieve en negatieve ionen uit elkaar te trekken.[2] - Sommige ionische verbindingen kleven niet erg goed aan elkaar; dit zijn oplosbaar omdat het water ze uit elkaar trekt en oplost. Andere verbindingen zijn sterker gebonden en zijn onoplosbaar omdat ze ondanks de watermoleculen aan elkaar kunnen blijven kleven.
- Sommige verbindingen hebben interne bindingen die qua sterkte vergelijkbaar zijn met de aantrekkingskracht van het water. Deze worden genoemd licht oplosbaar, omdat een aanzienlijke hoeveelheid verbindingen uit elkaar wordt getrokken, maar de rest blijft bij elkaar.
-
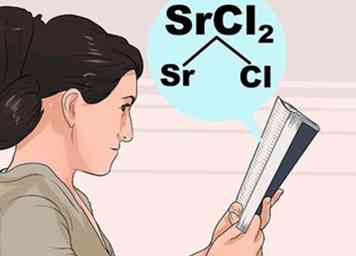 3 Bestudeer de regels voor oplosbaarheid. Omdat de interacties tussen atomen vrij complex zijn, is het niet altijd intuïtief welke verbindingen oplosbaar zijn en die onoplosbaar zijn. Zoek de eerste ion in de compound op de onderstaande lijst om erachter te komen hoe deze zich gewoonlijk gedraagt, en controleer vervolgens de uitzonderingen om te zorgen dat het tweede ion geen ongewone interactie heeft.
3 Bestudeer de regels voor oplosbaarheid. Omdat de interacties tussen atomen vrij complex zijn, is het niet altijd intuïtief welke verbindingen oplosbaar zijn en die onoplosbaar zijn. Zoek de eerste ion in de compound op de onderstaande lijst om erachter te komen hoe deze zich gewoonlijk gedraagt, en controleer vervolgens de uitzonderingen om te zorgen dat het tweede ion geen ongewone interactie heeft. - Bijvoorbeeld om Strontium Chloride (SrCl2), zoek naar Sr of Cl in de vetgedrukte stappen hieronder. Cl is "meestal oplosbaar", dus kijk hieronder voor uitzonderingen. Sr wordt niet vermeld als uitzondering, dus SrCl2 moet oplosbaar zijn.
- De meest voorkomende uitzonderingen op elke regel staan eronder. Er zijn andere uitzonderingen, maar het is onwaarschijnlijk dat u ze tegenkomt in een typische chemieklasse of laboratorium.
-
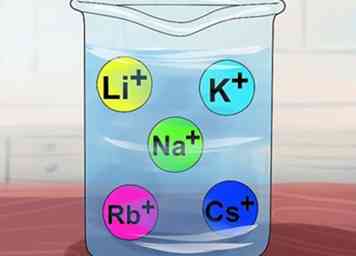 4 Erken dat verbindingen oplosbaar zijn als ze alkalimetalen bevatten. Alkalimetalen omvatten Li+, Na+, K+Rb+en Cs+. Deze worden ook de Groep IA-elementen genoemd: lithium, natrium, kalium, rubidium en cesium. Vrijwel elke verbinding die een van deze ionen bevat, is oplosbaar.
4 Erken dat verbindingen oplosbaar zijn als ze alkalimetalen bevatten. Alkalimetalen omvatten Li+, Na+, K+Rb+en Cs+. Deze worden ook de Groep IA-elementen genoemd: lithium, natrium, kalium, rubidium en cesium. Vrijwel elke verbinding die een van deze ionen bevat, is oplosbaar. - Uitzondering: Li3PO4 is onoplosbaar.
-
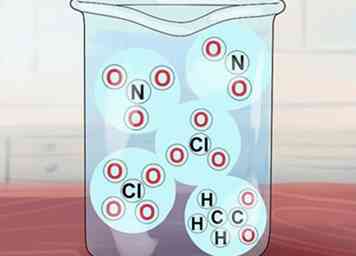 5 Begrijp dat sommige andere verbindingen oplosbaar zijn. Deze omvatten verbindingen van NO3-, C2H3O2-, NEE2-, ClO3-en ClO4-. Respectievelijk zijn dit de nitraat-, acetaat-, nitriet-, chloraat- en perchloraationen. Merk op dat acetaat vaak afgekort OAC is.[3]
5 Begrijp dat sommige andere verbindingen oplosbaar zijn. Deze omvatten verbindingen van NO3-, C2H3O2-, NEE2-, ClO3-en ClO4-. Respectievelijk zijn dit de nitraat-, acetaat-, nitriet-, chloraat- en perchloraationen. Merk op dat acetaat vaak afgekort OAC is.[3] - Uitzonderingen: Ag (OAc) (zilveracetaat) en Hg (OAc)2 (kwikacetaat) onoplosbaar.
- AgNO2- en KClO4- zijn slechts "enigszins oplosbaar".
-
 6 Merk op dat verbindingen van Cl-, Br-, en ik- zijn meestal oplosbaar. De chloride-, bromide- en jodide-ionen maken bijna altijd oplosbare verbindingen, halogeenzouten genaamd.
6 Merk op dat verbindingen van Cl-, Br-, en ik- zijn meestal oplosbaar. De chloride-, bromide- en jodide-ionen maken bijna altijd oplosbare verbindingen, halogeenzouten genaamd. - Uitzondering: Als een van deze paren met de ionen zilver Ag+, kwik Hg22+of leid Pb2+, het resultaat is onoplosbaar. Hetzelfde geldt voor minder vaak voorkomende verbindingen gemaakt van het koppelen met koper Cu+ en thallium Tl+.
-
 7 Realiseer je dat verbindingen die SO bevatten42- zijn meestal oplosbaar. Het sulfaation vormt in het algemeen oplosbare verbindingen, maar er zijn verschillende uitzonderingen.
7 Realiseer je dat verbindingen die SO bevatten42- zijn meestal oplosbaar. Het sulfaation vormt in het algemeen oplosbare verbindingen, maar er zijn verschillende uitzonderingen. - Uitzonderingen: Het sulfaation vormt onoplosbare verbindingen met de volgende ionen: strontium Sr2+, barium Ba2+, leid Pb2+, zilver Ag+, calcium Ca2+, radium Ra2+en diatomisch zilver Ag22+. Merk op dat zilver sulfaat en calciumsulfaat net genoeg oplossen dat sommige mensen ze enigszins oplosbaar noemen.
-
 8 Weet dat verbindingen die OH bevatten- of S2- zijn onoplosbaar. Dit zijn respectievelijk de hydroxide- en sulfide-ionen.
8 Weet dat verbindingen die OH bevatten- of S2- zijn onoplosbaar. Dit zijn respectievelijk de hydroxide- en sulfide-ionen. - Uitzonderingen: Denk aan de alkalimetalen (Groep I-A) en hoe ze graag oplosbare verbindingen vormen? Li+, Na+, K+Rb+en Cs+ alle vormen oplosbare verbindingen met de hydroxide- of sulfide-ionen. Bovendien vormt hydroxide oplosbare zouten met de alkalimetaal (Groep II-A) ionen: calcium Ca2+, strontium Sr2+en barium Ba2+. Merk op dat de verbindingen die het resultaat zijn van hydroxide en een alkalimetaal voldoende moleculen hebben die gebonden blijven om soms als "enigszins oplosbaar" te worden beschouwd.
-
 9 Begrijp dat verbindingen die CO bevatten32- of PO43- zijn onoplosbaar. Een laatste controle op carbonaat- en fosfaationen, en u moet weten wat u van uw stof kunt verwachten.
9 Begrijp dat verbindingen die CO bevatten32- of PO43- zijn onoplosbaar. Een laatste controle op carbonaat- en fosfaationen, en u moet weten wat u van uw stof kunt verwachten. - Uitzonderingen: Deze ionen vormen oplosbare verbindingen met de gebruikelijke verdachten, de alkalimetalen Li+, Na+, K+Rb+en Cs+, evenals met ammonium-NH4+.
Methode twee van twee:
Het berekenen van de oplosbaarheid van de Ksp
-
 1 Zoek de oplosbaarheid van het product op (Ksp). Deze constante is verschillend voor elke samenstelling, dus u moet deze opzoeken op een grafiek in uw leerboek. Omdat deze waarden experimenteel worden bepaald, kunnen ze sterk verschillen tussen diagrammen, dus het is het beste om met de grafiek van uw leerboek te gaan als deze er één heeft. Tenzij anders aangegeven, gaan de meeste diagrammen ervan uit dat u op 25ºC (77ºF) werkt.
1 Zoek de oplosbaarheid van het product op (Ksp). Deze constante is verschillend voor elke samenstelling, dus u moet deze opzoeken op een grafiek in uw leerboek. Omdat deze waarden experimenteel worden bepaald, kunnen ze sterk verschillen tussen diagrammen, dus het is het beste om met de grafiek van uw leerboek te gaan als deze er één heeft. Tenzij anders aangegeven, gaan de meeste diagrammen ervan uit dat u op 25ºC (77ºF) werkt. - Bijvoorbeeld als u loodjodide of PbI oplost2, noteer de constante oplosbaarheid van het product.
-
 2 Schrijf de chemische vergelijking. Bepaal eerst hoe de verbinding zich splitst in ionen wanneer deze oplost. Schrijf vervolgens een vergelijking met de Ksp aan de ene kant en de samenstellende ionen aan de andere kant.
2 Schrijf de chemische vergelijking. Bepaal eerst hoe de verbinding zich splitst in ionen wanneer deze oplost. Schrijf vervolgens een vergelijking met de Ksp aan de ene kant en de samenstellende ionen aan de andere kant. - Bijvoorbeeld een molecuul van PbI2 splitst zich in de ionen Pb2+, Ik-en een tweede ik-. (U hoeft alleen de lading op 1 ion te kennen of op te zoeken, omdat u weet dat de totale samenstelling altijd een neutrale lading zal hebben.)
- Schrijf de vergelijking 7.1 × 10-9 = [Pb2+][IK-]2
- De vergelijking is de constante oplosbaarheid van het product, die kan worden gevonden voor de 2 ionen in een oplosbaarheidsgrafiek. Aangezien er 2 I zijn- ionen, ik- is naar de tweede macht.
-
 3 Pas de vergelijking aan om variabelen te gebruiken. Herschrijf de vergelijking als een eenvoudig algebra-probleem, gebruikmakend van wat je weet over het aantal moleculen en ionen. Stel x in op de hoeveelheid van de verbinding die zal oplossen en herschrijf de variabelen die de aantallen van elk ion voorstellen in termen van x.
3 Pas de vergelijking aan om variabelen te gebruiken. Herschrijf de vergelijking als een eenvoudig algebra-probleem, gebruikmakend van wat je weet over het aantal moleculen en ionen. Stel x in op de hoeveelheid van de verbinding die zal oplossen en herschrijf de variabelen die de aantallen van elk ion voorstellen in termen van x. - In ons voorbeeld moeten we 7.1 × 10 herschrijven-9 = [Pb2+][IK-]2
- Aangezien er 1 loodion (Pb2+) in de verbinding zal het aantal moleculen van opgeloste verbindingen gelijk zijn aan het aantal vrije loodionen. Dus we kunnen [Pb2+] naar x.
- Aangezien er 2 jodiumionen zijn (I.-) voor elke lead-ion, kunnen we het aantal jodiumatomen instellen op 2x kwadraat.
- De vergelijking is nu 7.1 × 10-9 = (x) (2x)2
-
 4 Account voor gemeenschappelijke ionen, indien aanwezig. Sla deze stap over als u de verbinding in zuiver water oplost. Als de verbinding wordt opgelost in een oplossing die al een of meer van de samenstellende ionen bevat (een "gemeenschappelijk ion"), is de oplosbaarheid echter aanzienlijk verminderd.[4] Het algemene ioneffect is het meest opmerkelijk in verbindingen die meestal onoplosbaar zijn, en in deze gevallen kunt u ervan uitgaan dat de overgrote meerderheid van de ionen bij evenwicht afkomstig zijn van het ion dat al in de oplossing aanwezig is. Herschrijf de vergelijking om de bekende molconcentratie (mol per liter of M) van de ionen die al in de oplossing zitten, te vervangen door de waarde van x die u voor dat ion gebruikte.[5]
4 Account voor gemeenschappelijke ionen, indien aanwezig. Sla deze stap over als u de verbinding in zuiver water oplost. Als de verbinding wordt opgelost in een oplossing die al een of meer van de samenstellende ionen bevat (een "gemeenschappelijk ion"), is de oplosbaarheid echter aanzienlijk verminderd.[4] Het algemene ioneffect is het meest opmerkelijk in verbindingen die meestal onoplosbaar zijn, en in deze gevallen kunt u ervan uitgaan dat de overgrote meerderheid van de ionen bij evenwicht afkomstig zijn van het ion dat al in de oplossing aanwezig is. Herschrijf de vergelijking om de bekende molconcentratie (mol per liter of M) van de ionen die al in de oplossing zitten, te vervangen door de waarde van x die u voor dat ion gebruikte.[5] - Bijvoorbeeld, als onze loodjodideverbinding werd opgelost in een oplossing met 0,2 M loodchloride (PbCl2), zouden we onze vergelijking herschrijven als 7.1 × 10-9 = (0.2M + x) (2x)2. Omdat 0.2M dus een hogere concentratie heeft dan x, kunnen we het veilig herschrijven als 7.1 × 10-9 = (0.2M) (2x)2.
-
 5 Los De vergelijking op. Los op voor x en je weet hoe oplosbaar de verbinding is. Vanwege de definitie van de oplosbaarheidsconstante, is uw antwoord uitgedrukt in het aantal opgeloste moleculen van de verbinding per liter water. Mogelijk hebt u een rekenmachine nodig om het definitieve antwoord te vinden.
5 Los De vergelijking op. Los op voor x en je weet hoe oplosbaar de verbinding is. Vanwege de definitie van de oplosbaarheidsconstante, is uw antwoord uitgedrukt in het aantal opgeloste moleculen van de verbinding per liter water. Mogelijk hebt u een rekenmachine nodig om het definitieve antwoord te vinden. - Het volgende is voor oplosbaarheid in zuiver water, niet met gewone ionen.
- 7.1×10-9 = (x) (2x)2
- 7.1×10-9 = (x) (4x2)
- 7.1×10-9 = 4x3
- (7.1×10-9) ÷ 4 = x3
- x = ∛ ((7.1 × 10-9) ÷ 4)
- x = 1,2 x 10-3 mollen per liter lossen op. Dit is een zeer kleine hoeveelheid, dus u weet dat deze verbinding in wezen onoplosbaar is.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Meer informatie over ionische verbindingen. Elk atoom heeft normaal een bepaald aantal elektronen, maar soms nemen ze een extra elektron op of verliezen ze door een proces dat bekend staat als elektronenoverdracht.[1] Het resultaat is een ion, die een elektrische lading heeft. Wanneer een ion met een negatieve lading (een extra elektron) een ion ontmoet met een positieve lading (een elektron ontbreekt), binden ze zich samen net als de negatieve en positieve uiteinden van 2 magneten. Het resultaat is een ionische verbinding.
1 Meer informatie over ionische verbindingen. Elk atoom heeft normaal een bepaald aantal elektronen, maar soms nemen ze een extra elektron op of verliezen ze door een proces dat bekend staat als elektronenoverdracht.[1] Het resultaat is een ion, die een elektrische lading heeft. Wanneer een ion met een negatieve lading (een extra elektron) een ion ontmoet met een positieve lading (een elektron ontbreekt), binden ze zich samen net als de negatieve en positieve uiteinden van 2 magneten. Het resultaat is een ionische verbinding.  2 Begrijp de oplosbaarheid. Watermoleculen (H2O) hebben een ongewone structuur, waardoor ze lijken op een magneet: het ene uiteinde heeft een positieve lading, terwijl het andere einde negatief is. Wanneer je een ionische verbinding in water laat vallen, zullen deze watermagneten zich eromheen verzamelen en proberen de positieve en negatieve ionen uit elkaar te trekken.[2]
2 Begrijp de oplosbaarheid. Watermoleculen (H2O) hebben een ongewone structuur, waardoor ze lijken op een magneet: het ene uiteinde heeft een positieve lading, terwijl het andere einde negatief is. Wanneer je een ionische verbinding in water laat vallen, zullen deze watermagneten zich eromheen verzamelen en proberen de positieve en negatieve ionen uit elkaar te trekken.[2]  3 Bestudeer de regels voor oplosbaarheid. Omdat de interacties tussen atomen vrij complex zijn, is het niet altijd intuïtief welke verbindingen oplosbaar zijn en die onoplosbaar zijn. Zoek de eerste ion in de compound op de onderstaande lijst om erachter te komen hoe deze zich gewoonlijk gedraagt, en controleer vervolgens de uitzonderingen om te zorgen dat het tweede ion geen ongewone interactie heeft.
3 Bestudeer de regels voor oplosbaarheid. Omdat de interacties tussen atomen vrij complex zijn, is het niet altijd intuïtief welke verbindingen oplosbaar zijn en die onoplosbaar zijn. Zoek de eerste ion in de compound op de onderstaande lijst om erachter te komen hoe deze zich gewoonlijk gedraagt, en controleer vervolgens de uitzonderingen om te zorgen dat het tweede ion geen ongewone interactie heeft.  4 Erken dat verbindingen oplosbaar zijn als ze alkalimetalen bevatten. Alkalimetalen omvatten Li+, Na+, K+Rb+en Cs+. Deze worden ook de Groep IA-elementen genoemd: lithium, natrium, kalium, rubidium en cesium. Vrijwel elke verbinding die een van deze ionen bevat, is oplosbaar.
4 Erken dat verbindingen oplosbaar zijn als ze alkalimetalen bevatten. Alkalimetalen omvatten Li+, Na+, K+Rb+en Cs+. Deze worden ook de Groep IA-elementen genoemd: lithium, natrium, kalium, rubidium en cesium. Vrijwel elke verbinding die een van deze ionen bevat, is oplosbaar.  5 Begrijp dat sommige andere verbindingen oplosbaar zijn. Deze omvatten verbindingen van NO3-, C2H3O2-, NEE2-, ClO3-en ClO4-. Respectievelijk zijn dit de nitraat-, acetaat-, nitriet-, chloraat- en perchloraationen. Merk op dat acetaat vaak afgekort OAC is.[3]
5 Begrijp dat sommige andere verbindingen oplosbaar zijn. Deze omvatten verbindingen van NO3-, C2H3O2-, NEE2-, ClO3-en ClO4-. Respectievelijk zijn dit de nitraat-, acetaat-, nitriet-, chloraat- en perchloraationen. Merk op dat acetaat vaak afgekort OAC is.[3]  6 Merk op dat verbindingen van Cl-, Br-, en ik- zijn meestal oplosbaar. De chloride-, bromide- en jodide-ionen maken bijna altijd oplosbare verbindingen, halogeenzouten genaamd.
6 Merk op dat verbindingen van Cl-, Br-, en ik- zijn meestal oplosbaar. De chloride-, bromide- en jodide-ionen maken bijna altijd oplosbare verbindingen, halogeenzouten genaamd.  7 Realiseer je dat verbindingen die SO bevatten42- zijn meestal oplosbaar. Het sulfaation vormt in het algemeen oplosbare verbindingen, maar er zijn verschillende uitzonderingen.
7 Realiseer je dat verbindingen die SO bevatten42- zijn meestal oplosbaar. Het sulfaation vormt in het algemeen oplosbare verbindingen, maar er zijn verschillende uitzonderingen.  8 Weet dat verbindingen die OH bevatten- of S2- zijn onoplosbaar. Dit zijn respectievelijk de hydroxide- en sulfide-ionen.
8 Weet dat verbindingen die OH bevatten- of S2- zijn onoplosbaar. Dit zijn respectievelijk de hydroxide- en sulfide-ionen.  9 Begrijp dat verbindingen die CO bevatten32- of PO43- zijn onoplosbaar. Een laatste controle op carbonaat- en fosfaationen, en u moet weten wat u van uw stof kunt verwachten.
9 Begrijp dat verbindingen die CO bevatten32- of PO43- zijn onoplosbaar. Een laatste controle op carbonaat- en fosfaationen, en u moet weten wat u van uw stof kunt verwachten.  1 Zoek de oplosbaarheid van het product op (Ksp). Deze constante is verschillend voor elke samenstelling, dus u moet deze opzoeken op een grafiek in uw leerboek. Omdat deze waarden experimenteel worden bepaald, kunnen ze sterk verschillen tussen diagrammen, dus het is het beste om met de grafiek van uw leerboek te gaan als deze er één heeft. Tenzij anders aangegeven, gaan de meeste diagrammen ervan uit dat u op 25ºC (77ºF) werkt.
1 Zoek de oplosbaarheid van het product op (Ksp). Deze constante is verschillend voor elke samenstelling, dus u moet deze opzoeken op een grafiek in uw leerboek. Omdat deze waarden experimenteel worden bepaald, kunnen ze sterk verschillen tussen diagrammen, dus het is het beste om met de grafiek van uw leerboek te gaan als deze er één heeft. Tenzij anders aangegeven, gaan de meeste diagrammen ervan uit dat u op 25ºC (77ºF) werkt.  2 Schrijf de chemische vergelijking. Bepaal eerst hoe de verbinding zich splitst in ionen wanneer deze oplost. Schrijf vervolgens een vergelijking met de Ksp aan de ene kant en de samenstellende ionen aan de andere kant.
2 Schrijf de chemische vergelijking. Bepaal eerst hoe de verbinding zich splitst in ionen wanneer deze oplost. Schrijf vervolgens een vergelijking met de Ksp aan de ene kant en de samenstellende ionen aan de andere kant.  3 Pas de vergelijking aan om variabelen te gebruiken. Herschrijf de vergelijking als een eenvoudig algebra-probleem, gebruikmakend van wat je weet over het aantal moleculen en ionen. Stel x in op de hoeveelheid van de verbinding die zal oplossen en herschrijf de variabelen die de aantallen van elk ion voorstellen in termen van x.
3 Pas de vergelijking aan om variabelen te gebruiken. Herschrijf de vergelijking als een eenvoudig algebra-probleem, gebruikmakend van wat je weet over het aantal moleculen en ionen. Stel x in op de hoeveelheid van de verbinding die zal oplossen en herschrijf de variabelen die de aantallen van elk ion voorstellen in termen van x.  4 Account voor gemeenschappelijke ionen, indien aanwezig. Sla deze stap over als u de verbinding in zuiver water oplost. Als de verbinding wordt opgelost in een oplossing die al een of meer van de samenstellende ionen bevat (een "gemeenschappelijk ion"), is de oplosbaarheid echter aanzienlijk verminderd.[4] Het algemene ioneffect is het meest opmerkelijk in verbindingen die meestal onoplosbaar zijn, en in deze gevallen kunt u ervan uitgaan dat de overgrote meerderheid van de ionen bij evenwicht afkomstig zijn van het ion dat al in de oplossing aanwezig is. Herschrijf de vergelijking om de bekende molconcentratie (mol per liter of M) van de ionen die al in de oplossing zitten, te vervangen door de waarde van x die u voor dat ion gebruikte.[5]
4 Account voor gemeenschappelijke ionen, indien aanwezig. Sla deze stap over als u de verbinding in zuiver water oplost. Als de verbinding wordt opgelost in een oplossing die al een of meer van de samenstellende ionen bevat (een "gemeenschappelijk ion"), is de oplosbaarheid echter aanzienlijk verminderd.[4] Het algemene ioneffect is het meest opmerkelijk in verbindingen die meestal onoplosbaar zijn, en in deze gevallen kunt u ervan uitgaan dat de overgrote meerderheid van de ionen bij evenwicht afkomstig zijn van het ion dat al in de oplossing aanwezig is. Herschrijf de vergelijking om de bekende molconcentratie (mol per liter of M) van de ionen die al in de oplossing zitten, te vervangen door de waarde van x die u voor dat ion gebruikte.[5]  5 Los De vergelijking op. Los op voor x en je weet hoe oplosbaar de verbinding is. Vanwege de definitie van de oplosbaarheidsconstante, is uw antwoord uitgedrukt in het aantal opgeloste moleculen van de verbinding per liter water. Mogelijk hebt u een rekenmachine nodig om het definitieve antwoord te vinden.
5 Los De vergelijking op. Los op voor x en je weet hoe oplosbaar de verbinding is. Vanwege de definitie van de oplosbaarheidsconstante, is uw antwoord uitgedrukt in het aantal opgeloste moleculen van de verbinding per liter water. Mogelijk hebt u een rekenmachine nodig om het definitieve antwoord te vinden.