In de chemie verwijzen de termen "oxidatie" en "reductie" naar reacties waarbij een atoom (of groep van atomen) elektronen verliest of wint. Oxidatiegetallen zijn getallen toegekend aan atomen (of groepen atomen) die chemici helpen bij te houden hoeveel elektronen beschikbaar zijn voor overdracht en of gegeven reactanten worden geoxideerd of gereduceerd in een reactie. Het proces van toewijzing van oxidatienummers aan atomen kan variëren van opmerkelijk eenvoudig tot enigszins complex, gebaseerd op de lading van de atomen en de chemische samenstelling van de moleculen waarvan ze deel uitmaken. Om zaken te compliceren, kunnen sommige atomen meer dan één oxidatie nummer hebben. Gelukkig wordt de toewijzing van oxidatienummers beheerst door welomschreven, gemakkelijk te volgen regels, hoewel kennis van elementaire chemie en algebra navigatie van deze regels veel gemakkelijker zal maken.
Deel een van de twee:
Oxydatienummers toewijzen op basis van chemische regels
-
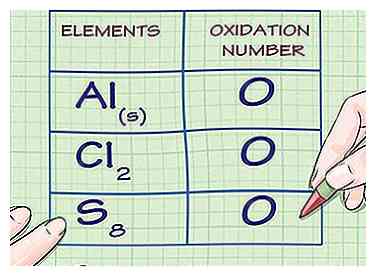 1 Bepaal of de stof in kwestie elementair is. Vrije, ongecombineerde elementaire atomen hebben altijd een oxidatiegetal van 0. Dit geldt zowel voor atomen waarvan de elementaire vorm is samengesteld uit een eenzaam atoom, als voor atomen waarvan de elementaire vorm diatomisch of polyatomisch is.
1 Bepaal of de stof in kwestie elementair is. Vrije, ongecombineerde elementaire atomen hebben altijd een oxidatiegetal van 0. Dit geldt zowel voor atomen waarvan de elementaire vorm is samengesteld uit een eenzaam atoom, als voor atomen waarvan de elementaire vorm diatomisch of polyatomisch is. - Bijvoorbeeld Al(S) en Cl2 beide hebben oxidatiegetallen van 0 omdat ze zich in hun niet-gecombineerde elementaire vormen bevinden.
- Merk op dat de elementaire vorm van Sulphur, S8of octasulfur, hoewel onregelmatig, heeft ook een oxidatiegetal van 0.
-
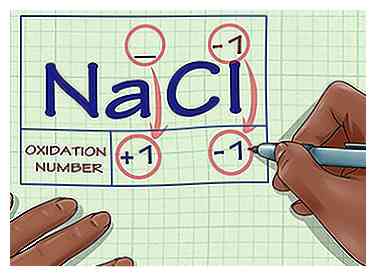 2 Bepaal of de stof in kwestie een ion is. Ionen hebben oxidatiecijfers die gelijk zijn aan hun lading. Dit geldt zowel voor ionen die niet zijn gebonden aan andere elementen als voor ionen die deel uitmaken van een ionische verbinding.
2 Bepaal of de stof in kwestie een ion is. Ionen hebben oxidatiecijfers die gelijk zijn aan hun lading. Dit geldt zowel voor ionen die niet zijn gebonden aan andere elementen als voor ionen die deel uitmaken van een ionische verbinding. - Bijvoorbeeld, het ion Cl- heeft een oxidatiegetal van -1.
- Het Cl ion nog steeds heeft een oxidatiegetal van -1 als het deel uitmaakt van de verbinding NaCl. Omdat het Na-ion per definitie een lading van +1 heeft, weten we dat het Cl-ion een lading van -1 heeft, dus het oxidatiegetal is nog steeds -1.
-
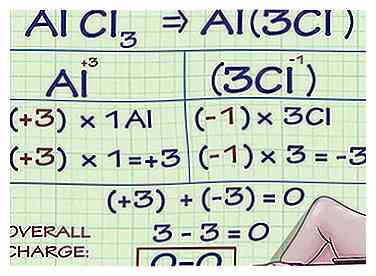 3 Voor metaalionen, weet dat er meerdere oxidatiegetallen mogelijk zijn. Veel metalen elementen kunnen meerdere ladingen bevatten. Het metaalijzer (Fe) kan bijvoorbeeld een ion zijn met een lading van +2 of +3.[1] De ladingen van metallische ionen (en dus oxidatienummers) kunnen worden bepaald in relatie tot de ladingen van andere atomen in de verbinding waarvan ze deel uitmaken, of, wanneer ze in tekst zijn geschreven, volgens Romeinse cijfernotatie (zoals in de zin: "De ijzer (III) ion heeft een lading van +3. ").
3 Voor metaalionen, weet dat er meerdere oxidatiegetallen mogelijk zijn. Veel metalen elementen kunnen meerdere ladingen bevatten. Het metaalijzer (Fe) kan bijvoorbeeld een ion zijn met een lading van +2 of +3.[1] De ladingen van metallische ionen (en dus oxidatienummers) kunnen worden bepaald in relatie tot de ladingen van andere atomen in de verbinding waarvan ze deel uitmaken, of, wanneer ze in tekst zijn geschreven, volgens Romeinse cijfernotatie (zoals in de zin: "De ijzer (III) ion heeft een lading van +3. "). - Laten we bijvoorbeeld een verbinding onderzoeken die het metaalaluminiumion bevat. De verbinding AlCl3 heeft een totale lading van 0. Omdat we weten dat Cl- ionen hebben een lading van -1 en er zijn 3 Cl- ionen in de verbinding, moet het Al-ion een lading van +3 hebben, zodat de totale lading van alle ionen toeneemt tot 0. Al's oxidatiegetal is dus +3.
-
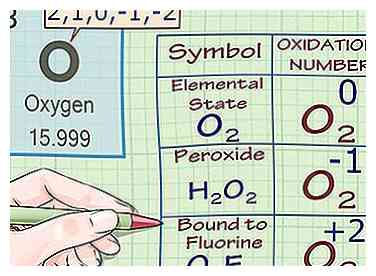 4 Ken een oxidatie-getal toe van -2 tot zuurstof (met uitzonderingen). In bijna In alle gevallen hebben zuurstofatomen oxidatiegetallen van -2. Er zijn een paar uitzonderingen op deze regel:
4 Ken een oxidatie-getal toe van -2 tot zuurstof (met uitzonderingen). In bijna In alle gevallen hebben zuurstofatomen oxidatiegetallen van -2. Er zijn een paar uitzonderingen op deze regel: - Wanneer zuurstof zich in zijn elementaire toestand bevindt (O2), het oxidatiegetal is 0, zoals het geval is voor alle elementaire atomen.
- Wanneer zuurstof onderdeel is van een peroxide, het oxidatiegetal is -1. Peroxiden zijn een klasse verbindingen die een zuurstof-zuurstof-enkele binding bevatten (of het peroxide-anion O2-2). Bijvoorbeeld in het molecuul H2O2 (waterstofperoxide), zuurstof heeft een oxidatiegetal (en een lading) van -1. Ook wanneer zuurstof deel uitmaakt van een superoxide is het oxidatiegetal -0,5
- Wanneer zuurstof wordt gebonden aan fluor, is het oxidatiegetal +2. Zie Fluorieregel hieronder voor meer info. In (O2F2) het is +1.
-
 5 Ken een oxidatie nummer van +1 toe aan waterstof (met uitzonderingen). Net als zuurstof is het oxidatie-nummer van waterstof onderhevig aan uitzonderlijke gevallen. Over het algemeen heeft waterstof een oxidatie-aantal van +1 (tenzij, zoals hierboven, het in zijn elementaire vorm is, H2). In het geval van speciale verbindingen die hydriden worden genoemd, heeft waterstof echter een oxidatiegetal van -1.
5 Ken een oxidatie nummer van +1 toe aan waterstof (met uitzonderingen). Net als zuurstof is het oxidatie-nummer van waterstof onderhevig aan uitzonderlijke gevallen. Over het algemeen heeft waterstof een oxidatie-aantal van +1 (tenzij, zoals hierboven, het in zijn elementaire vorm is, H2). In het geval van speciale verbindingen die hydriden worden genoemd, heeft waterstof echter een oxidatiegetal van -1. - Bijvoorbeeld in H2O, we weten dat waterstof een oxidatie-aantal heeft van +1 omdat zuurstof een lading van -2 heeft en we hebben 2 +1 ladingen nodig om de kosten van de verbinding op nul te krijgen. In natriumhydride, NaH, heeft waterstof echter een oxidatiegetal van -1 omdat het Na-ion een lading van +1 heeft en, voor de totale lading van de verbinding tot gelijk aan nul, de waterstoflading (en dus het oxidatiegetal) gelijk moet zijn aan -1.
-
 6 fluorine altijd heeft een oxidatiegetal van -1. Zoals hierboven vermeld, kunnen de oxidatiegetallen van bepaalde elementen variëren voor verschillende factoren (metaalionen, zuurstofatomen in peroxiden, enz.). Fluor heeft echter een oxidatiegetal van -1, dat nooit verandert. Dit komt omdat fluor het meest elektronegatieve element is - met andere woorden, het is het element dat het minst waarschijnlijk is dat het zijn eigen elektronen opgeeft en waarschijnlijk een ander atoom zal innemen. Daarom verandert de lading niet.
6 fluorine altijd heeft een oxidatiegetal van -1. Zoals hierboven vermeld, kunnen de oxidatiegetallen van bepaalde elementen variëren voor verschillende factoren (metaalionen, zuurstofatomen in peroxiden, enz.). Fluor heeft echter een oxidatiegetal van -1, dat nooit verandert. Dit komt omdat fluor het meest elektronegatieve element is - met andere woorden, het is het element dat het minst waarschijnlijk is dat het zijn eigen elektronen opgeeft en waarschijnlijk een ander atoom zal innemen. Daarom verandert de lading niet. -
 7 Stel de oxidatiecijfers in een samenstelling in die gelijk is aan de lading van een verbinding. De oxidatiegetallen van alle atomen in een verbinding moeten bij elkaar optellen tot de lading van die verbinding. Als een verbinding bijvoorbeeld geen lading heeft, moeten de oxidatiegetallen van elk van de atomen ervan nul zijn; als de verbinding een polyatomair ion is met een lading van -1, moeten de oxidatiegetallen oplopen tot -1, enz.
7 Stel de oxidatiecijfers in een samenstelling in die gelijk is aan de lading van een verbinding. De oxidatiegetallen van alle atomen in een verbinding moeten bij elkaar optellen tot de lading van die verbinding. Als een verbinding bijvoorbeeld geen lading heeft, moeten de oxidatiegetallen van elk van de atomen ervan nul zijn; als de verbinding een polyatomair ion is met een lading van -1, moeten de oxidatiegetallen oplopen tot -1, enz. - Dit is een goede manier om uw werk te controleren - als de oxidatie in uw verbindingen niet overeenkomt met de lading van uw compound, weet u dat u er een of meer onjuist hebt toegewezen.
Deel twee van twee:
Cijfers toewijzen aan Atomen zonder Regels voor Oxidatiecijfers
-
 1 Vind atomen zonder regels voor oxidatienummers. Sommige atomen hebben geen specifieke regels over de oxidatiecijfers die ze kunnen hebben.Als je atoom niet in de bovenstaande regels voorkomt en je niet zeker weet wat de lading is (bijvoorbeeld als het deel uitmaakt van een grotere verbinding en de individuele lading niet wordt weergegeven), kun je het oxidatie-nummer van het atoom per proces vinden van eliminatie. Eerst bepaal je de oxidatie van elk ander atoom in de compound, dan kun je simpelweg het onbekende oplossen op basis van de totale lading van de verbinding.
1 Vind atomen zonder regels voor oxidatienummers. Sommige atomen hebben geen specifieke regels over de oxidatiecijfers die ze kunnen hebben.Als je atoom niet in de bovenstaande regels voorkomt en je niet zeker weet wat de lading is (bijvoorbeeld als het deel uitmaakt van een grotere verbinding en de individuele lading niet wordt weergegeven), kun je het oxidatie-nummer van het atoom per proces vinden van eliminatie. Eerst bepaal je de oxidatie van elk ander atoom in de compound, dan kun je simpelweg het onbekende oplossen op basis van de totale lading van de verbinding. - Bijvoorbeeld in de verbinding Na2ZO4, de lading van Zwavel (S) is onbekend - het is niet in zijn elementaire vorm, dus het is geen 0, maar dat is alles wat we weten. Dit is een goede kandidaat voor deze methode voor de bepaling van algebraïsche oxidatiecijfers.
-
 2 Zoek het bekende oxidatienummer voor de andere elementen in de verbinding. Gebruik de regels voor de toewijzing van oxidatiecijfers om oxidatienummers toe te wijzen aan de andere atomen in de compound. Wees op uw hoede voor uitzonderlijke gevallen voor O, H, etc.
2 Zoek het bekende oxidatienummer voor de andere elementen in de verbinding. Gebruik de regels voor de toewijzing van oxidatiecijfers om oxidatienummers toe te wijzen aan de andere atomen in de compound. Wees op uw hoede voor uitzonderlijke gevallen voor O, H, etc. - In Na2ZO4, we weten, gebaseerd op onze verzameling regels, dat het Na-ion een lading (en dus een oxidatie-aantal) van +1 heeft en dat de zuurstofatomen oxidatiegetallen van -2 hebben.
-
 3 Vermenigvuldig het aantal van elk atoom door zijn oxidatie nummer. Nu we het oxidatiegetal van al onze atomen kennen, behalve de onbekende, moeten we rekening houden met het feit dat sommige van deze atomen meer dan eens voorkomen. Vermenigvuldig de numerieke coëfficiënt van elk atoom (geschreven in subscript na het chemische symbool van het atoom in de verbinding) met het oxidatiegetal.
3 Vermenigvuldig het aantal van elk atoom door zijn oxidatie nummer. Nu we het oxidatiegetal van al onze atomen kennen, behalve de onbekende, moeten we rekening houden met het feit dat sommige van deze atomen meer dan eens voorkomen. Vermenigvuldig de numerieke coëfficiënt van elk atoom (geschreven in subscript na het chemische symbool van het atoom in de verbinding) met het oxidatiegetal. - In Na2ZO4, we weten dat er 2 Na-atomen en 4 O-atomen zijn. We zouden 2 × +1, het oxidatie nummer van Na, vermenigvuldigen om een antwoord van 2 te krijgen, en we zouden 4 × -2, het oxidatie nummer van O, vermenigvuldigen om een antwoord van -8 te krijgen.
-
 4 Voeg de resultaten samen toe. Door de resultaten van uw vermenigvuldigingen samen toe te voegen, krijgt u het huidige oxidatie nummer van de compound zonder rekening houdend met het oxidatie nummer van je onbekende atoom.
4 Voeg de resultaten samen toe. Door de resultaten van uw vermenigvuldigingen samen toe te voegen, krijgt u het huidige oxidatie nummer van de compound zonder rekening houdend met het oxidatie nummer van je onbekende atoom. - In onze Na2ZO4 We voegen bijvoorbeeld 2 toe aan -8 om -6 te krijgen.
-
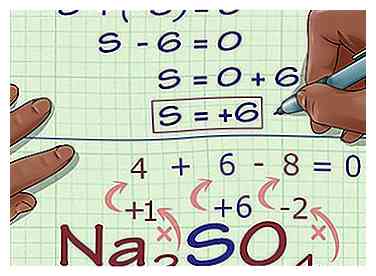 5 Bereken het onbekende oxidatienummer op basis van de lading van de verbinding. Je hebt nu alles wat je nodig hebt om je onbekende oxidatie nummer te vinden met behulp van eenvoudige algebra. Stel een vergelijking in die uw antwoord uit de vorige stap heeft plus het onbekende oxidatie nummer dat gelijk is aan de totale lading van de compound. Met andere woorden: (Som van bekende oxidatiegetallen) + (onbekend oxidatie nummer dat u aan het oplossen bent) = (lading van de verbinding).
5 Bereken het onbekende oxidatienummer op basis van de lading van de verbinding. Je hebt nu alles wat je nodig hebt om je onbekende oxidatie nummer te vinden met behulp van eenvoudige algebra. Stel een vergelijking in die uw antwoord uit de vorige stap heeft plus het onbekende oxidatie nummer dat gelijk is aan de totale lading van de compound. Met andere woorden: (Som van bekende oxidatiegetallen) + (onbekend oxidatie nummer dat u aan het oplossen bent) = (lading van de verbinding). - In onze Na2ZO4 We lossen dit bijvoorbeeld als volgt op:
- (Som van bekende oxidatiegetallen) + (onbekend oxidatie nummer dat u aan het oplossen bent) = (lading van de verbinding)
- -6 + S = 0
- S = 0 + 6
- S = 6. S heeft een oxidatie-aantal van 6 in Na2ZO4.
- In onze Na2ZO4 We lossen dit bijvoorbeeld als volgt op:
 Minotauromaquia
Minotauromaquia
 1 Bepaal of de stof in kwestie elementair is. Vrije, ongecombineerde elementaire atomen hebben altijd een oxidatiegetal van 0. Dit geldt zowel voor atomen waarvan de elementaire vorm is samengesteld uit een eenzaam atoom, als voor atomen waarvan de elementaire vorm diatomisch of polyatomisch is.
1 Bepaal of de stof in kwestie elementair is. Vrije, ongecombineerde elementaire atomen hebben altijd een oxidatiegetal van 0. Dit geldt zowel voor atomen waarvan de elementaire vorm is samengesteld uit een eenzaam atoom, als voor atomen waarvan de elementaire vorm diatomisch of polyatomisch is.  2 Bepaal of de stof in kwestie een ion is. Ionen hebben oxidatiecijfers die gelijk zijn aan hun lading. Dit geldt zowel voor ionen die niet zijn gebonden aan andere elementen als voor ionen die deel uitmaken van een ionische verbinding.
2 Bepaal of de stof in kwestie een ion is. Ionen hebben oxidatiecijfers die gelijk zijn aan hun lading. Dit geldt zowel voor ionen die niet zijn gebonden aan andere elementen als voor ionen die deel uitmaken van een ionische verbinding. 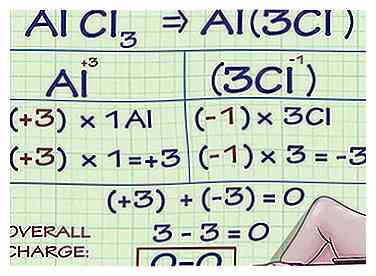 3 Voor metaalionen, weet dat er meerdere oxidatiegetallen mogelijk zijn. Veel metalen elementen kunnen meerdere ladingen bevatten. Het metaalijzer (Fe) kan bijvoorbeeld een ion zijn met een lading van +2 of +3.[1] De ladingen van metallische ionen (en dus oxidatienummers) kunnen worden bepaald in relatie tot de ladingen van andere atomen in de verbinding waarvan ze deel uitmaken, of, wanneer ze in tekst zijn geschreven, volgens Romeinse cijfernotatie (zoals in de zin: "De ijzer (III) ion heeft een lading van +3. ").
3 Voor metaalionen, weet dat er meerdere oxidatiegetallen mogelijk zijn. Veel metalen elementen kunnen meerdere ladingen bevatten. Het metaalijzer (Fe) kan bijvoorbeeld een ion zijn met een lading van +2 of +3.[1] De ladingen van metallische ionen (en dus oxidatienummers) kunnen worden bepaald in relatie tot de ladingen van andere atomen in de verbinding waarvan ze deel uitmaken, of, wanneer ze in tekst zijn geschreven, volgens Romeinse cijfernotatie (zoals in de zin: "De ijzer (III) ion heeft een lading van +3. ").  4 Ken een oxidatie-getal toe van -2 tot zuurstof (met uitzonderingen). In bijna In alle gevallen hebben zuurstofatomen oxidatiegetallen van -2. Er zijn een paar uitzonderingen op deze regel:
4 Ken een oxidatie-getal toe van -2 tot zuurstof (met uitzonderingen). In bijna In alle gevallen hebben zuurstofatomen oxidatiegetallen van -2. Er zijn een paar uitzonderingen op deze regel:  5 Ken een oxidatie nummer van +1 toe aan waterstof (met uitzonderingen). Net als zuurstof is het oxidatie-nummer van waterstof onderhevig aan uitzonderlijke gevallen. Over het algemeen heeft waterstof een oxidatie-aantal van +1 (tenzij, zoals hierboven, het in zijn elementaire vorm is, H2). In het geval van speciale verbindingen die hydriden worden genoemd, heeft waterstof echter een oxidatiegetal van -1.
5 Ken een oxidatie nummer van +1 toe aan waterstof (met uitzonderingen). Net als zuurstof is het oxidatie-nummer van waterstof onderhevig aan uitzonderlijke gevallen. Over het algemeen heeft waterstof een oxidatie-aantal van +1 (tenzij, zoals hierboven, het in zijn elementaire vorm is, H2). In het geval van speciale verbindingen die hydriden worden genoemd, heeft waterstof echter een oxidatiegetal van -1.  6 fluorine altijd heeft een oxidatiegetal van -1. Zoals hierboven vermeld, kunnen de oxidatiegetallen van bepaalde elementen variëren voor verschillende factoren (metaalionen, zuurstofatomen in peroxiden, enz.). Fluor heeft echter een oxidatiegetal van -1, dat nooit verandert. Dit komt omdat fluor het meest elektronegatieve element is - met andere woorden, het is het element dat het minst waarschijnlijk is dat het zijn eigen elektronen opgeeft en waarschijnlijk een ander atoom zal innemen. Daarom verandert de lading niet.
6 fluorine altijd heeft een oxidatiegetal van -1. Zoals hierboven vermeld, kunnen de oxidatiegetallen van bepaalde elementen variëren voor verschillende factoren (metaalionen, zuurstofatomen in peroxiden, enz.). Fluor heeft echter een oxidatiegetal van -1, dat nooit verandert. Dit komt omdat fluor het meest elektronegatieve element is - met andere woorden, het is het element dat het minst waarschijnlijk is dat het zijn eigen elektronen opgeeft en waarschijnlijk een ander atoom zal innemen. Daarom verandert de lading niet.  7 Stel de oxidatiecijfers in een samenstelling in die gelijk is aan de lading van een verbinding. De oxidatiegetallen van alle atomen in een verbinding moeten bij elkaar optellen tot de lading van die verbinding. Als een verbinding bijvoorbeeld geen lading heeft, moeten de oxidatiegetallen van elk van de atomen ervan nul zijn; als de verbinding een polyatomair ion is met een lading van -1, moeten de oxidatiegetallen oplopen tot -1, enz.
7 Stel de oxidatiecijfers in een samenstelling in die gelijk is aan de lading van een verbinding. De oxidatiegetallen van alle atomen in een verbinding moeten bij elkaar optellen tot de lading van die verbinding. Als een verbinding bijvoorbeeld geen lading heeft, moeten de oxidatiegetallen van elk van de atomen ervan nul zijn; als de verbinding een polyatomair ion is met een lading van -1, moeten de oxidatiegetallen oplopen tot -1, enz.  1 Vind atomen zonder regels voor oxidatienummers. Sommige atomen hebben geen specifieke regels over de oxidatiecijfers die ze kunnen hebben.Als je atoom niet in de bovenstaande regels voorkomt en je niet zeker weet wat de lading is (bijvoorbeeld als het deel uitmaakt van een grotere verbinding en de individuele lading niet wordt weergegeven), kun je het oxidatie-nummer van het atoom per proces vinden van eliminatie. Eerst bepaal je de oxidatie van elk ander atoom in de compound, dan kun je simpelweg het onbekende oplossen op basis van de totale lading van de verbinding.
1 Vind atomen zonder regels voor oxidatienummers. Sommige atomen hebben geen specifieke regels over de oxidatiecijfers die ze kunnen hebben.Als je atoom niet in de bovenstaande regels voorkomt en je niet zeker weet wat de lading is (bijvoorbeeld als het deel uitmaakt van een grotere verbinding en de individuele lading niet wordt weergegeven), kun je het oxidatie-nummer van het atoom per proces vinden van eliminatie. Eerst bepaal je de oxidatie van elk ander atoom in de compound, dan kun je simpelweg het onbekende oplossen op basis van de totale lading van de verbinding.  2 Zoek het bekende oxidatienummer voor de andere elementen in de verbinding. Gebruik de regels voor de toewijzing van oxidatiecijfers om oxidatienummers toe te wijzen aan de andere atomen in de compound. Wees op uw hoede voor uitzonderlijke gevallen voor O, H, etc.
2 Zoek het bekende oxidatienummer voor de andere elementen in de verbinding. Gebruik de regels voor de toewijzing van oxidatiecijfers om oxidatienummers toe te wijzen aan de andere atomen in de compound. Wees op uw hoede voor uitzonderlijke gevallen voor O, H, etc.  3 Vermenigvuldig het aantal van elk atoom door zijn oxidatie nummer. Nu we het oxidatiegetal van al onze atomen kennen, behalve de onbekende, moeten we rekening houden met het feit dat sommige van deze atomen meer dan eens voorkomen. Vermenigvuldig de numerieke coëfficiënt van elk atoom (geschreven in subscript na het chemische symbool van het atoom in de verbinding) met het oxidatiegetal.
3 Vermenigvuldig het aantal van elk atoom door zijn oxidatie nummer. Nu we het oxidatiegetal van al onze atomen kennen, behalve de onbekende, moeten we rekening houden met het feit dat sommige van deze atomen meer dan eens voorkomen. Vermenigvuldig de numerieke coëfficiënt van elk atoom (geschreven in subscript na het chemische symbool van het atoom in de verbinding) met het oxidatiegetal.  4 Voeg de resultaten samen toe. Door de resultaten van uw vermenigvuldigingen samen toe te voegen, krijgt u het huidige oxidatie nummer van de compound zonder rekening houdend met het oxidatie nummer van je onbekende atoom.
4 Voeg de resultaten samen toe. Door de resultaten van uw vermenigvuldigingen samen toe te voegen, krijgt u het huidige oxidatie nummer van de compound zonder rekening houdend met het oxidatie nummer van je onbekende atoom. 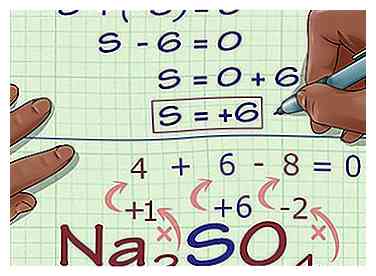 5 Bereken het onbekende oxidatienummer op basis van de lading van de verbinding. Je hebt nu alles wat je nodig hebt om je onbekende oxidatie nummer te vinden met behulp van eenvoudige algebra. Stel een vergelijking in die uw antwoord uit de vorige stap heeft plus het onbekende oxidatie nummer dat gelijk is aan de totale lading van de compound. Met andere woorden: (Som van bekende oxidatiegetallen) + (onbekend oxidatie nummer dat u aan het oplossen bent) = (lading van de verbinding).
5 Bereken het onbekende oxidatienummer op basis van de lading van de verbinding. Je hebt nu alles wat je nodig hebt om je onbekende oxidatie nummer te vinden met behulp van eenvoudige algebra. Stel een vergelijking in die uw antwoord uit de vorige stap heeft plus het onbekende oxidatie nummer dat gelijk is aan de totale lading van de compound. Met andere woorden: (Som van bekende oxidatiegetallen) + (onbekend oxidatie nummer dat u aan het oplossen bent) = (lading van de verbinding).