Gramkleuring is een snelle procedure om de aanwezigheid van bacteriën in weefselmonsters te bepalen en om bacteriën te karakteriseren als grampositief of gramnegatief, gebaseerd op de chemische en fysische eigenschappen van hun celwanden.[1] De Gram-kleuring moet bijna altijd worden uitgevoerd als de eerste stap in de diagnose van een bacterie-infectie.
De Gram-kleuring is vernoemd naar de Deense wetenschapper Hans Christian Gram (1853 - 1938), die de techniek in 1882 ontwikkelde en deze in 1884 publiceerde als een techniek om onderscheid te maken tussen twee soorten bacteriën met vergelijkbare klinische symptomen: Streptococcus pneumoniae (ook bekend als de pneumococcus) en Klebsiella pneumoniae bacteriën.[2]
Deel een van de drie:
Een gramkleuring voorbereiden
-
 1 Bereid je voor op laboratoriumwerk. Trek handschoenen aan en bind lang haar vast om besmetting van het bacteriemonster dat u gaat testen te voorkomen. Desinfecteer een werkruimte onder de zuurkast of in een andere goed geventileerde ruimte. Controleer of de bunsenbrander en microscoop functioneel zijn voordat u begint.
1 Bereid je voor op laboratoriumwerk. Trek handschoenen aan en bind lang haar vast om besmetting van het bacteriemonster dat u gaat testen te voorkomen. Desinfecteer een werkruimte onder de zuurkast of in een andere goed geventileerde ruimte. Controleer of de bunsenbrander en microscoop functioneel zijn voordat u begint. -
 2 Steriliseer een glazen microscoopglaasje. Als de glasplaat vuil is, wast u deze in een sopje om vet en vuil te verwijderen. Desinfecteer de glaasjes met ethanol, glasreiniger of welke methode ook wordt aanbevolen door uw laboratorium.
2 Steriliseer een glazen microscoopglaasje. Als de glasplaat vuil is, wast u deze in een sopje om vet en vuil te verwijderen. Desinfecteer de glaasjes met ethanol, glasreiniger of welke methode ook wordt aanbevolen door uw laboratorium. -
 3 Voeg het monster toe aan de dia. U kunt de Gram-vlekmethode gebruiken om bacteriën te identificeren die aanwezig zijn in medische monsters, of bacteriële culturen die in een petrischaal worden gekweekt. Om de Gram-kleuring nuttig te laten zijn, voegt u een toe dun laag van het monster op de vlek. Een monster van minder dan 24 uur oud wordt aanbevolen, omdat oudere bacteriën mogelijk beschadigde celwanden hebben die minder voorspelbaar reageren op gramkleuring.[3]
3 Voeg het monster toe aan de dia. U kunt de Gram-vlekmethode gebruiken om bacteriën te identificeren die aanwezig zijn in medische monsters, of bacteriële culturen die in een petrischaal worden gekweekt. Om de Gram-kleuring nuttig te laten zijn, voegt u een toe dun laag van het monster op de vlek. Een monster van minder dan 24 uur oud wordt aanbevolen, omdat oudere bacteriën mogelijk beschadigde celwanden hebben die minder voorspelbaar reageren op gramkleuring.[3] - Als u een weefselmonster gebruikt, voegt u 1-2 druppels op de glasplaat toe. Verdeel het gelijkmatig over de dia om een dun uitstrijkje te vormen, met behulp van de rand van een tweede gesteriliseerde glasplaatje. Laat het aan de lucht drogen alvorens verder te gaan.
- Als u bacteriën uit een petrischaal neemt, steriliseer dan een entingslus in een vlam van een bunsenbrander totdat deze gloeit en laat hem vervolgens afkoelen. Gebruik het om een druppel steriel water op de glaasje te plaatsen, steriliseer en koell de lus vervolgens opnieuw voor het overbrengen van een klein monster bacteriën en voorzichtig roeren in het water.[4]
- Bacteriën in bouillon moeten worden gemengd in een vortexer en vervolgens worden toegevoegd met een inentingslus zoals hierboven, zonder toevoeging van het extra water.[5]
- Als u een staafje hebt, rol het staafje dan lichtjes over de dia.[6]
-
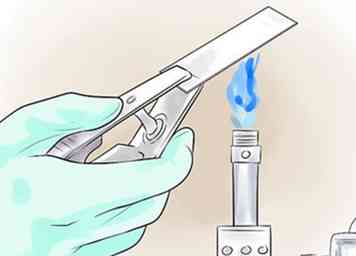 4 Verhit het uitstrijkje. Warmte zal de bacteriën op de glijbaan fixeren, zodat ze tijdens de vlek niet zo gemakkelijk worden afgespoeld. Laat de schuif twee tot drie keer snel door een vlam van een bunsenbrander gaan, of verwarm hem op een elektrische schuifverwarmer. Niet oververhitten, anders kunnen de samples vervormd raken. Als je een bunsenbrander gebruikt, moet de vlam een kleine, blauwe kegel zijn, niet een grote oranje.[7]
4 Verhit het uitstrijkje. Warmte zal de bacteriën op de glijbaan fixeren, zodat ze tijdens de vlek niet zo gemakkelijk worden afgespoeld. Laat de schuif twee tot drie keer snel door een vlam van een bunsenbrander gaan, of verwarm hem op een elektrische schuifverwarmer. Niet oververhitten, anders kunnen de samples vervormd raken. Als je een bunsenbrander gebruikt, moet de vlam een kleine, blauwe kegel zijn, niet een grote oranje.[7] - Als alternatief kan het uitstrijkje in plaats daarvan worden gefixeerd met methanol, door 1-2 druppels methanol aan het gedroogde uitstrijkje toe te voegen, de overtollige methanol af te tappen en aan de lucht te laten drogen. Deze methode minimaliseert de schade aan de gastheercellen en geeft een schonere achtergrond.
-
 5 Plaats de dia op een kleurbak. Een kleurbakje is een schaal van ondiep metaal, glas of plastic met een kleine maas of draadsteun die over de bovenkant loopt. Plaats de dia bovenop deze steun, zodat de vloeistoffen die u gaat gebruiken, in de lade kunnen lopen.
5 Plaats de dia op een kleurbak. Een kleurbakje is een schaal van ondiep metaal, glas of plastic met een kleine maas of draadsteun die over de bovenkant loopt. Plaats de dia bovenop deze steun, zodat de vloeistoffen die u gaat gebruiken, in de lade kunnen lopen. - Als u geen kleurbakje heeft, kan de dia direct op een plastic ijsblokjesplateau worden geplaatst.[8]
Tweede deel van de drie:
De gramkleuring uitvoeren
-
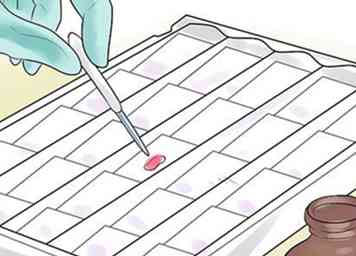 1 Overgiet het uitstrijkje met kristalviolet. Gebruik een pipet om het bacteriemonster te laten overstromen met verschillende druppels kristal violette kleurstof, ook wel gentiaan violet genoemd. Wacht dertig tot zestig seconden. Crystal violet (CV) dissocieert in waterige oplossingen in CV + en chloride (Cl-) ionen. Deze ionen dringen door de celwand en het celmembraan van zowel grampositieve als gramnegatieve cellen. Het CV + -ion interageert met negatief geladen componenten van bacteriële cellen om de cellen paars te kleuren.
1 Overgiet het uitstrijkje met kristalviolet. Gebruik een pipet om het bacteriemonster te laten overstromen met verschillende druppels kristal violette kleurstof, ook wel gentiaan violet genoemd. Wacht dertig tot zestig seconden. Crystal violet (CV) dissocieert in waterige oplossingen in CV + en chloride (Cl-) ionen. Deze ionen dringen door de celwand en het celmembraan van zowel grampositieve als gramnegatieve cellen. Het CV + -ion interageert met negatief geladen componenten van bacteriële cellen om de cellen paars te kleuren. - Veel laboratoria gebruiken "Hucker's" kristalviolet, dat ammoniumoxalaat toevoegt om neerslag te voorkomen.[9]
-
 2 Spoel het kristalviolet voorzichtig af. Kantel de dia en gebruik een wasfles om een kleine stroom gedestilleerd of kraanwater over de glasplaat te spuiten. Het water moet over het oppervlak van het uitstrijkje naar beneden lopen, maar er niet direct op worden gericht.[10] Spoel niet te veel, waardoor de vlek kan worden verwijderd van Gram-positieve bacteriën.
2 Spoel het kristalviolet voorzichtig af. Kantel de dia en gebruik een wasfles om een kleine stroom gedestilleerd of kraanwater over de glasplaat te spuiten. Het water moet over het oppervlak van het uitstrijkje naar beneden lopen, maar er niet direct op worden gericht.[10] Spoel niet te veel, waardoor de vlek kan worden verwijderd van Gram-positieve bacteriën. -
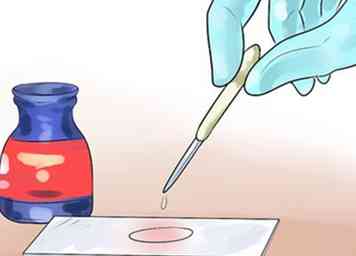 3 Overgiet het uitstrijkje met jodium en spoel het vervolgens uit. Gebruik een pipet om het uitstrijkje te bedekken met jodium. Laat het minstens 60 seconden zitten en spoel het daarna af met dezelfde zorgvuldige methode.[11] Jodium, in de vorm van negatief geladen ionen, interageert met CV + en vormt grote complexen van kristalviolet en jodium (CV-I-complexen) binnen de binnenste en buitenste lagen van de cel. Dit zal de paarse kristalviolette kleur in de cel vangen, waar het ook gekleurd is.
3 Overgiet het uitstrijkje met jodium en spoel het vervolgens uit. Gebruik een pipet om het uitstrijkje te bedekken met jodium. Laat het minstens 60 seconden zitten en spoel het daarna af met dezelfde zorgvuldige methode.[11] Jodium, in de vorm van negatief geladen ionen, interageert met CV + en vormt grote complexen van kristalviolet en jodium (CV-I-complexen) binnen de binnenste en buitenste lagen van de cel. Dit zal de paarse kristalviolette kleur in de cel vangen, waar het ook gekleurd is. - Jodium is bijtend. Vermijd inademing, inslikken of huidcontact.
-
 4 Voeg een ontkleuringsmiddel toe en spoel vervolgens snel. Een 1: 1-mengsel van aceton en ethanol wordt meestal gebruikt voor deze kritieke stap, die zorgvuldig moet worden getimed. Houd de dia schuin en voeg de ontkleurer toe totdat er geen paarse kleur meer zichtbaar is in de afvoer. Dit duurt meestal minder dan 10 seconden, of zelfs minder als het ontkleuringsmiddel hogere concentraties aceton bevat. Stop onmiddellijk of de ontkleuring verwijdert de kristalviolette kleur van zowel grampositieve als negatieve cellen en de vlek moet worden herhaald. Spoel het overtollige ontkleuringsmiddel onmiddellijk af met behulp van de eerdere techniek.
4 Voeg een ontkleuringsmiddel toe en spoel vervolgens snel. Een 1: 1-mengsel van aceton en ethanol wordt meestal gebruikt voor deze kritieke stap, die zorgvuldig moet worden getimed. Houd de dia schuin en voeg de ontkleurer toe totdat er geen paarse kleur meer zichtbaar is in de afvoer. Dit duurt meestal minder dan 10 seconden, of zelfs minder als het ontkleuringsmiddel hogere concentraties aceton bevat. Stop onmiddellijk of de ontkleuring verwijdert de kristalviolette kleur van zowel grampositieve als negatieve cellen en de vlek moet worden herhaald. Spoel het overtollige ontkleuringsmiddel onmiddellijk af met behulp van de eerdere techniek. - Pure (95% +) aceton kan in plaats daarvan worden gebruikt.[12] Hoe meer aceton er is, hoe sneller de ontkleuringsverf zal werken, wat een preciezere timing vereist.
- Als u problemen ondervindt bij het bepalen van de timing van deze stap, overweeg dan om de decolorizer druppel voor druppel toe te voegen.[13]
-
 5 Flood het uitstrijkje met tegenverkleuring en spoel vervolgens. Een tegenkleuring, meestal safranine of fuchsine, wordt gebruikt om extra contrast tussen gram-negatieve en gram-positieve bacteriën toe te voegen, door ontkleurde (gramnegatieve) bacteriën roze of rood te kleuren.[14][15] Laat het minimaal 45 seconden inwerken en spoel het daarna af.[16]
5 Flood het uitstrijkje met tegenverkleuring en spoel vervolgens. Een tegenkleuring, meestal safranine of fuchsine, wordt gebruikt om extra contrast tussen gram-negatieve en gram-positieve bacteriën toe te voegen, door ontkleurde (gramnegatieve) bacteriën roze of rood te kleuren.[14][15] Laat het minimaal 45 seconden inwerken en spoel het daarna af.[16] - Fuchsin kleurt veel gram-negatieve bacteriën intenser, zoals haemophilus spp en legionella spp.[17] Dit maakt het misschien een betere optie voor beginners.
-
 6 Droog de dia. U kunt het glaasje aan de lucht laten drogen of het droog laten drogen met behulp van absorberend papier dat voor dit doel wordt verkocht.[18] De Gram-kleuring is voltooid.
6 Droog de dia. U kunt het glaasje aan de lucht laten drogen of het droog laten drogen met behulp van absorberend papier dat voor dit doel wordt verkocht.[18] De Gram-kleuring is voltooid.
Derde deel van de drie:
Het resultaat onderzoeken
-
 1 Bereid de lichtmicroscoop voor. Plaats de dia onder de lichtmicroscoop. Bacteriën variëren sterk in grootte, dus de totale vereiste vergroting varieert van 400x tot 1000x.[19] Aan het hogere uiteinde van deze vergrotingen wordt een objectief met olie-immersie aanbevolen voor meer duidelijkheid. Plaats een druppel onderdompelingsolie op de dia, vermijd beweging tijdens het aanbrengen om luchtbellen te voorkomen.[20] Verplaats de microscoopkop zodat de objectieflens op zijn plaats klikt en de olie raakt.
1 Bereid de lichtmicroscoop voor. Plaats de dia onder de lichtmicroscoop. Bacteriën variëren sterk in grootte, dus de totale vereiste vergroting varieert van 400x tot 1000x.[19] Aan het hogere uiteinde van deze vergrotingen wordt een objectief met olie-immersie aanbevolen voor meer duidelijkheid. Plaats een druppel onderdompelingsolie op de dia, vermijd beweging tijdens het aanbrengen om luchtbellen te voorkomen.[20] Verplaats de microscoopkop zodat de objectieflens op zijn plaats klikt en de olie raakt. - Olie-immersie kan alleen worden gebruikt op speciaal ontworpen lenzen, niet op een "droge" lens.
-
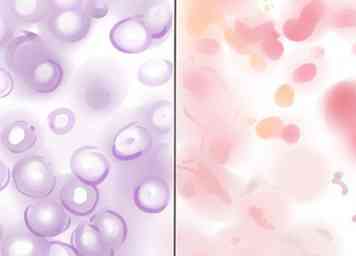 2 Identificeer gram-positieve en gram-negatieve bacteriën. Bestudeer de dia onder de lichtmicroscoop. Gram-positieve bacteriën lijken paars, vanwege het kristalviolet gevangen in hun dikke celwanden. Gram-negatieve bacteriën verschijnen roze of rood, omdat het viooltje door de dunne celwanden spoelt, waarna de roze tegenkleuring ze binnenging.
2 Identificeer gram-positieve en gram-negatieve bacteriën. Bestudeer de dia onder de lichtmicroscoop. Gram-positieve bacteriën lijken paars, vanwege het kristalviolet gevangen in hun dikke celwanden. Gram-negatieve bacteriën verschijnen roze of rood, omdat het viooltje door de dunne celwanden spoelt, waarna de roze tegenkleuring ze binnenging. - Als het monster te dik is, ziet u mogelijk vals positieve resultaten. Kleur een nieuw monster als alle bacterietypen grampositief zijn, om zeker te zijn dat het resultaat klopt.
- Als de ontkleuringspoeder te lang loopt, ziet u mogelijk vals negatieve resultaten. Kleur een nieuw monster als alle bacterietypen gramnegatief zijn, om uw resultaten te controleren.
-
 3 Zoek referentiebeelden op. Als u niet zeker weet wat een bacterie is, kijk dan door een verzameling referentiebeelden, gesorteerd op vorm en resultaat van de gramkleuring. U kunt databases online vinden in de National Microbial Pathogen Database, Bacteria in Photos en vele andere sites. Om de identificatie te vergemakkelijken, worden algemene of diagnostisch belangrijke voorbeelden hieronder gesorteerd op gramstatus en vorm.
3 Zoek referentiebeelden op. Als u niet zeker weet wat een bacterie is, kijk dan door een verzameling referentiebeelden, gesorteerd op vorm en resultaat van de gramkleuring. U kunt databases online vinden in de National Microbial Pathogen Database, Bacteria in Photos en vele andere sites. Om de identificatie te vergemakkelijken, worden algemene of diagnostisch belangrijke voorbeelden hieronder gesorteerd op gramstatus en vorm. -
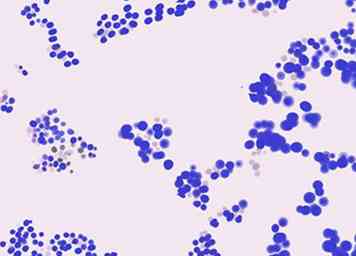 4 Identificeer gram-positieve bacteriën per vorm. Bacteriën worden verder geclassificeerd door hun vorm onder de microscoop, meestal als cocci (bolvormig) of staven (cilindrisch). Hier zijn een paar veel voorkomende Gram-positieve (paars-gekleurde) bacteriën, gerangschikt naar vorm:
4 Identificeer gram-positieve bacteriën per vorm. Bacteriën worden verder geclassificeerd door hun vorm onder de microscoop, meestal als cocci (bolvormig) of staven (cilindrisch). Hier zijn een paar veel voorkomende Gram-positieve (paars-gekleurde) bacteriën, gerangschikt naar vorm: - Gram-positieve kokken zijn over het algemeen ook Staphylococci (wat betekent cocci in clusters) of streptokokken (betekent cocci in ketens).
- Gram-positieve staven omvatten Bacil, Clostridium, Corynebacterium, en Listeria. Actinomyces spp. staven hebben vaak takken of filamenten.[21]
-
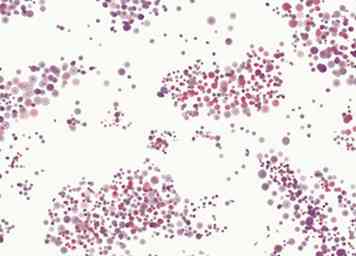 5 Identificeer gram-negatieve bacteriën. Gram-negatieve (roze-gekleurde) bacteriën worden vaak ingedeeld in drie groepen. Cocci zijn bolvormige bacteriën, staafjes zijn lange, dunne bacteriën en coccoïde staven bevinden zich ergens tussenin.
5 Identificeer gram-negatieve bacteriën. Gram-negatieve (roze-gekleurde) bacteriën worden vaak ingedeeld in drie groepen. Cocci zijn bolvormige bacteriën, staafjes zijn lange, dunne bacteriën en coccoïde staven bevinden zich ergens tussenin. - Gram-negatieve cocci zijn meestal Neisseria spp.
- Gram-negatieve staven omvatten E coli, Enterobacter, Klebsiella, Citrobacter, Serratia, Proteus, Salmonella, Shigella, Pseudomonas, en vele anderen. Vibrio cholerae kunnen verschijnen als gewone staven of gebogen staven.[22]
- Gram-negatieve "coccoïde" staven (of "coccobacilli") omvatten Bordetella, Brucella, Haemophilus, en Pasteurella.
-
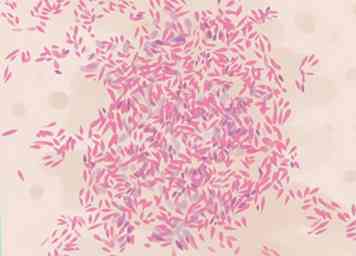 6 Evalueer gemengde resultaten. Sommige bacteriën zijn moeilijk nauwkeurig te kleuren, vanwege de broosheid of wasachtigheid van hun celwanden. Ze kunnen een combinatie van paarse of roze vlek in dezelfde cel hebben, of uit verschillende cellen in hetzelfde uitstrijkje. Elke bacteriesteekproef van meer dan 24 uur oud kan dit probleem hebben, maar sommige soorten zijn moeilijk te beitsen op elke leeftijd. Ze kunnen meer gespecialiseerde tests vereisen om de identificatie te beperken, zoals een zuurvaste kleuring, observatie van kweekgroei, TSI-mediumculturen of genetische testen.[23]
6 Evalueer gemengde resultaten. Sommige bacteriën zijn moeilijk nauwkeurig te kleuren, vanwege de broosheid of wasachtigheid van hun celwanden. Ze kunnen een combinatie van paarse of roze vlek in dezelfde cel hebben, of uit verschillende cellen in hetzelfde uitstrijkje. Elke bacteriesteekproef van meer dan 24 uur oud kan dit probleem hebben, maar sommige soorten zijn moeilijk te beitsen op elke leeftijd. Ze kunnen meer gespecialiseerde tests vereisen om de identificatie te beperken, zoals een zuurvaste kleuring, observatie van kweekgroei, TSI-mediumculturen of genetische testen.[23] - Actinomyces, Arthobacter, Corynebacterium, Mycobacterium, en Propionibacterium spp. worden allemaal als gram-positieve bacteriën beschouwd, maar lijken vaak inconclusief bevlekt.[24]
- Kleine en slanke bacteriën zoals Treponema, Chlamydia, en Rickettsia spp. zijn moeilijk te Gram-vlekken op de juiste manier.[25]
-
 7 Voer materialen af. Afvalverwerkingsprocedures variëren tussen laboratoria en volgens de gebruikte materialen. Meestal wordt de vloeistof in de kleuringsschaal weggegooid in flessen als gevaarlijk afval. Week dia's in een bleekoplossing van 10% en gooi ze vervolgens weg in scherpe containers.
7 Voer materialen af. Afvalverwerkingsprocedures variëren tussen laboratoria en volgens de gebruikte materialen. Meestal wordt de vloeistof in de kleuringsschaal weggegooid in flessen als gevaarlijk afval. Week dia's in een bleekoplossing van 10% en gooi ze vervolgens weg in scherpe containers.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Bereid je voor op laboratoriumwerk. Trek handschoenen aan en bind lang haar vast om besmetting van het bacteriemonster dat u gaat testen te voorkomen. Desinfecteer een werkruimte onder de zuurkast of in een andere goed geventileerde ruimte. Controleer of de bunsenbrander en microscoop functioneel zijn voordat u begint.
1 Bereid je voor op laboratoriumwerk. Trek handschoenen aan en bind lang haar vast om besmetting van het bacteriemonster dat u gaat testen te voorkomen. Desinfecteer een werkruimte onder de zuurkast of in een andere goed geventileerde ruimte. Controleer of de bunsenbrander en microscoop functioneel zijn voordat u begint.  2 Steriliseer een glazen microscoopglaasje. Als de glasplaat vuil is, wast u deze in een sopje om vet en vuil te verwijderen. Desinfecteer de glaasjes met ethanol, glasreiniger of welke methode ook wordt aanbevolen door uw laboratorium.
2 Steriliseer een glazen microscoopglaasje. Als de glasplaat vuil is, wast u deze in een sopje om vet en vuil te verwijderen. Desinfecteer de glaasjes met ethanol, glasreiniger of welke methode ook wordt aanbevolen door uw laboratorium.  3 Voeg het monster toe aan de dia. U kunt de Gram-vlekmethode gebruiken om bacteriën te identificeren die aanwezig zijn in medische monsters, of bacteriële culturen die in een petrischaal worden gekweekt. Om de Gram-kleuring nuttig te laten zijn, voegt u een toe dun laag van het monster op de vlek. Een monster van minder dan 24 uur oud wordt aanbevolen, omdat oudere bacteriën mogelijk beschadigde celwanden hebben die minder voorspelbaar reageren op gramkleuring.[3]
3 Voeg het monster toe aan de dia. U kunt de Gram-vlekmethode gebruiken om bacteriën te identificeren die aanwezig zijn in medische monsters, of bacteriële culturen die in een petrischaal worden gekweekt. Om de Gram-kleuring nuttig te laten zijn, voegt u een toe dun laag van het monster op de vlek. Een monster van minder dan 24 uur oud wordt aanbevolen, omdat oudere bacteriën mogelijk beschadigde celwanden hebben die minder voorspelbaar reageren op gramkleuring.[3]  4 Verhit het uitstrijkje. Warmte zal de bacteriën op de glijbaan fixeren, zodat ze tijdens de vlek niet zo gemakkelijk worden afgespoeld. Laat de schuif twee tot drie keer snel door een vlam van een bunsenbrander gaan, of verwarm hem op een elektrische schuifverwarmer. Niet oververhitten, anders kunnen de samples vervormd raken. Als je een bunsenbrander gebruikt, moet de vlam een kleine, blauwe kegel zijn, niet een grote oranje.[7]
4 Verhit het uitstrijkje. Warmte zal de bacteriën op de glijbaan fixeren, zodat ze tijdens de vlek niet zo gemakkelijk worden afgespoeld. Laat de schuif twee tot drie keer snel door een vlam van een bunsenbrander gaan, of verwarm hem op een elektrische schuifverwarmer. Niet oververhitten, anders kunnen de samples vervormd raken. Als je een bunsenbrander gebruikt, moet de vlam een kleine, blauwe kegel zijn, niet een grote oranje.[7]  5 Plaats de dia op een kleurbak. Een kleurbakje is een schaal van ondiep metaal, glas of plastic met een kleine maas of draadsteun die over de bovenkant loopt. Plaats de dia bovenop deze steun, zodat de vloeistoffen die u gaat gebruiken, in de lade kunnen lopen.
5 Plaats de dia op een kleurbak. Een kleurbakje is een schaal van ondiep metaal, glas of plastic met een kleine maas of draadsteun die over de bovenkant loopt. Plaats de dia bovenop deze steun, zodat de vloeistoffen die u gaat gebruiken, in de lade kunnen lopen.  1 Overgiet het uitstrijkje met kristalviolet. Gebruik een pipet om het bacteriemonster te laten overstromen met verschillende druppels kristal violette kleurstof, ook wel gentiaan violet genoemd. Wacht dertig tot zestig seconden. Crystal violet (CV) dissocieert in waterige oplossingen in CV + en chloride (Cl-) ionen. Deze ionen dringen door de celwand en het celmembraan van zowel grampositieve als gramnegatieve cellen. Het CV + -ion interageert met negatief geladen componenten van bacteriële cellen om de cellen paars te kleuren.
1 Overgiet het uitstrijkje met kristalviolet. Gebruik een pipet om het bacteriemonster te laten overstromen met verschillende druppels kristal violette kleurstof, ook wel gentiaan violet genoemd. Wacht dertig tot zestig seconden. Crystal violet (CV) dissocieert in waterige oplossingen in CV + en chloride (Cl-) ionen. Deze ionen dringen door de celwand en het celmembraan van zowel grampositieve als gramnegatieve cellen. Het CV + -ion interageert met negatief geladen componenten van bacteriële cellen om de cellen paars te kleuren.  2 Spoel het kristalviolet voorzichtig af. Kantel de dia en gebruik een wasfles om een kleine stroom gedestilleerd of kraanwater over de glasplaat te spuiten. Het water moet over het oppervlak van het uitstrijkje naar beneden lopen, maar er niet direct op worden gericht.[10] Spoel niet te veel, waardoor de vlek kan worden verwijderd van Gram-positieve bacteriën.
2 Spoel het kristalviolet voorzichtig af. Kantel de dia en gebruik een wasfles om een kleine stroom gedestilleerd of kraanwater over de glasplaat te spuiten. Het water moet over het oppervlak van het uitstrijkje naar beneden lopen, maar er niet direct op worden gericht.[10] Spoel niet te veel, waardoor de vlek kan worden verwijderd van Gram-positieve bacteriën.  3 Overgiet het uitstrijkje met jodium en spoel het vervolgens uit. Gebruik een pipet om het uitstrijkje te bedekken met jodium. Laat het minstens 60 seconden zitten en spoel het daarna af met dezelfde zorgvuldige methode.[11] Jodium, in de vorm van negatief geladen ionen, interageert met CV + en vormt grote complexen van kristalviolet en jodium (CV-I-complexen) binnen de binnenste en buitenste lagen van de cel. Dit zal de paarse kristalviolette kleur in de cel vangen, waar het ook gekleurd is.
3 Overgiet het uitstrijkje met jodium en spoel het vervolgens uit. Gebruik een pipet om het uitstrijkje te bedekken met jodium. Laat het minstens 60 seconden zitten en spoel het daarna af met dezelfde zorgvuldige methode.[11] Jodium, in de vorm van negatief geladen ionen, interageert met CV + en vormt grote complexen van kristalviolet en jodium (CV-I-complexen) binnen de binnenste en buitenste lagen van de cel. Dit zal de paarse kristalviolette kleur in de cel vangen, waar het ook gekleurd is.  4 Voeg een ontkleuringsmiddel toe en spoel vervolgens snel. Een 1: 1-mengsel van aceton en ethanol wordt meestal gebruikt voor deze kritieke stap, die zorgvuldig moet worden getimed. Houd de dia schuin en voeg de ontkleurer toe totdat er geen paarse kleur meer zichtbaar is in de afvoer. Dit duurt meestal minder dan 10 seconden, of zelfs minder als het ontkleuringsmiddel hogere concentraties aceton bevat. Stop onmiddellijk of de ontkleuring verwijdert de kristalviolette kleur van zowel grampositieve als negatieve cellen en de vlek moet worden herhaald. Spoel het overtollige ontkleuringsmiddel onmiddellijk af met behulp van de eerdere techniek.
4 Voeg een ontkleuringsmiddel toe en spoel vervolgens snel. Een 1: 1-mengsel van aceton en ethanol wordt meestal gebruikt voor deze kritieke stap, die zorgvuldig moet worden getimed. Houd de dia schuin en voeg de ontkleurer toe totdat er geen paarse kleur meer zichtbaar is in de afvoer. Dit duurt meestal minder dan 10 seconden, of zelfs minder als het ontkleuringsmiddel hogere concentraties aceton bevat. Stop onmiddellijk of de ontkleuring verwijdert de kristalviolette kleur van zowel grampositieve als negatieve cellen en de vlek moet worden herhaald. Spoel het overtollige ontkleuringsmiddel onmiddellijk af met behulp van de eerdere techniek.  5 Flood het uitstrijkje met tegenverkleuring en spoel vervolgens. Een tegenkleuring, meestal safranine of fuchsine, wordt gebruikt om extra contrast tussen gram-negatieve en gram-positieve bacteriën toe te voegen, door ontkleurde (gramnegatieve) bacteriën roze of rood te kleuren.[14][15] Laat het minimaal 45 seconden inwerken en spoel het daarna af.[16]
5 Flood het uitstrijkje met tegenverkleuring en spoel vervolgens. Een tegenkleuring, meestal safranine of fuchsine, wordt gebruikt om extra contrast tussen gram-negatieve en gram-positieve bacteriën toe te voegen, door ontkleurde (gramnegatieve) bacteriën roze of rood te kleuren.[14][15] Laat het minimaal 45 seconden inwerken en spoel het daarna af.[16]  6 Droog de dia. U kunt het glaasje aan de lucht laten drogen of het droog laten drogen met behulp van absorberend papier dat voor dit doel wordt verkocht.[18] De Gram-kleuring is voltooid.
6 Droog de dia. U kunt het glaasje aan de lucht laten drogen of het droog laten drogen met behulp van absorberend papier dat voor dit doel wordt verkocht.[18] De Gram-kleuring is voltooid.  1 Bereid de lichtmicroscoop voor. Plaats de dia onder de lichtmicroscoop. Bacteriën variëren sterk in grootte, dus de totale vereiste vergroting varieert van 400x tot 1000x.[19] Aan het hogere uiteinde van deze vergrotingen wordt een objectief met olie-immersie aanbevolen voor meer duidelijkheid. Plaats een druppel onderdompelingsolie op de dia, vermijd beweging tijdens het aanbrengen om luchtbellen te voorkomen.[20] Verplaats de microscoopkop zodat de objectieflens op zijn plaats klikt en de olie raakt.
1 Bereid de lichtmicroscoop voor. Plaats de dia onder de lichtmicroscoop. Bacteriën variëren sterk in grootte, dus de totale vereiste vergroting varieert van 400x tot 1000x.[19] Aan het hogere uiteinde van deze vergrotingen wordt een objectief met olie-immersie aanbevolen voor meer duidelijkheid. Plaats een druppel onderdompelingsolie op de dia, vermijd beweging tijdens het aanbrengen om luchtbellen te voorkomen.[20] Verplaats de microscoopkop zodat de objectieflens op zijn plaats klikt en de olie raakt.  2 Identificeer gram-positieve en gram-negatieve bacteriën. Bestudeer de dia onder de lichtmicroscoop. Gram-positieve bacteriën lijken paars, vanwege het kristalviolet gevangen in hun dikke celwanden. Gram-negatieve bacteriën verschijnen roze of rood, omdat het viooltje door de dunne celwanden spoelt, waarna de roze tegenkleuring ze binnenging.
2 Identificeer gram-positieve en gram-negatieve bacteriën. Bestudeer de dia onder de lichtmicroscoop. Gram-positieve bacteriën lijken paars, vanwege het kristalviolet gevangen in hun dikke celwanden. Gram-negatieve bacteriën verschijnen roze of rood, omdat het viooltje door de dunne celwanden spoelt, waarna de roze tegenkleuring ze binnenging.  3 Zoek referentiebeelden op. Als u niet zeker weet wat een bacterie is, kijk dan door een verzameling referentiebeelden, gesorteerd op vorm en resultaat van de gramkleuring. U kunt databases online vinden in de National Microbial Pathogen Database, Bacteria in Photos en vele andere sites. Om de identificatie te vergemakkelijken, worden algemene of diagnostisch belangrijke voorbeelden hieronder gesorteerd op gramstatus en vorm.
3 Zoek referentiebeelden op. Als u niet zeker weet wat een bacterie is, kijk dan door een verzameling referentiebeelden, gesorteerd op vorm en resultaat van de gramkleuring. U kunt databases online vinden in de National Microbial Pathogen Database, Bacteria in Photos en vele andere sites. Om de identificatie te vergemakkelijken, worden algemene of diagnostisch belangrijke voorbeelden hieronder gesorteerd op gramstatus en vorm.  4 Identificeer gram-positieve bacteriën per vorm. Bacteriën worden verder geclassificeerd door hun vorm onder de microscoop, meestal als cocci (bolvormig) of staven (cilindrisch). Hier zijn een paar veel voorkomende Gram-positieve (paars-gekleurde) bacteriën, gerangschikt naar vorm:
4 Identificeer gram-positieve bacteriën per vorm. Bacteriën worden verder geclassificeerd door hun vorm onder de microscoop, meestal als cocci (bolvormig) of staven (cilindrisch). Hier zijn een paar veel voorkomende Gram-positieve (paars-gekleurde) bacteriën, gerangschikt naar vorm:  5 Identificeer gram-negatieve bacteriën. Gram-negatieve (roze-gekleurde) bacteriën worden vaak ingedeeld in drie groepen. Cocci zijn bolvormige bacteriën, staafjes zijn lange, dunne bacteriën en coccoïde staven bevinden zich ergens tussenin.
5 Identificeer gram-negatieve bacteriën. Gram-negatieve (roze-gekleurde) bacteriën worden vaak ingedeeld in drie groepen. Cocci zijn bolvormige bacteriën, staafjes zijn lange, dunne bacteriën en coccoïde staven bevinden zich ergens tussenin.  6 Evalueer gemengde resultaten. Sommige bacteriën zijn moeilijk nauwkeurig te kleuren, vanwege de broosheid of wasachtigheid van hun celwanden. Ze kunnen een combinatie van paarse of roze vlek in dezelfde cel hebben, of uit verschillende cellen in hetzelfde uitstrijkje. Elke bacteriesteekproef van meer dan 24 uur oud kan dit probleem hebben, maar sommige soorten zijn moeilijk te beitsen op elke leeftijd. Ze kunnen meer gespecialiseerde tests vereisen om de identificatie te beperken, zoals een zuurvaste kleuring, observatie van kweekgroei, TSI-mediumculturen of genetische testen.[23]
6 Evalueer gemengde resultaten. Sommige bacteriën zijn moeilijk nauwkeurig te kleuren, vanwege de broosheid of wasachtigheid van hun celwanden. Ze kunnen een combinatie van paarse of roze vlek in dezelfde cel hebben, of uit verschillende cellen in hetzelfde uitstrijkje. Elke bacteriesteekproef van meer dan 24 uur oud kan dit probleem hebben, maar sommige soorten zijn moeilijk te beitsen op elke leeftijd. Ze kunnen meer gespecialiseerde tests vereisen om de identificatie te beperken, zoals een zuurvaste kleuring, observatie van kweekgroei, TSI-mediumculturen of genetische testen.[23]  7 Voer materialen af. Afvalverwerkingsprocedures variëren tussen laboratoria en volgens de gebruikte materialen. Meestal wordt de vloeistof in de kleuringsschaal weggegooid in flessen als gevaarlijk afval. Week dia's in een bleekoplossing van 10% en gooi ze vervolgens weg in scherpe containers.
7 Voer materialen af. Afvalverwerkingsprocedures variëren tussen laboratoria en volgens de gebruikte materialen. Meestal wordt de vloeistof in de kleuringsschaal weggegooid in flessen als gevaarlijk afval. Week dia's in een bleekoplossing van 10% en gooi ze vervolgens weg in scherpe containers.